Hvorfor er vand mindre flygtigt end carbon tetra -chlorid?
* stærkere intermolekylære kræfter: Vandmolekyler danner stærke brintbindinger med hinanden. Hydrogenbindinger er den stærkeste type intermolekylære kræfter, der kræver betydelig energi til at bryde. I modsætning hertil CCL 4 Molekyler udviser kun svage London -spredningskræfter, som let overvindes.
* Højere kogepunkt: Vandets stærke brintbindinger resulterer i et markant højere kogepunkt (100 ° C) sammenlignet med CCL 4 (76,7 ° C). Dette betyder, at vand har brug for mere energi for at skifte fra væske til gas.
* Polaritet: Vand er et meget polært molekyle på grund af elektronegativitetsforskellen mellem ilt og brint. Denne polaritet forbedrer hydrogenbinding, hvilket yderligere bidrager til dens lavere volatilitet. CCL 4 På den anden side er ikke-polær, og mangler de stærke dipol-dipol-interaktioner, der ville øge dens volatilitet.
Sammenfattende gør den stærke hydrogenbinding i vandmolekyler det vanskeligere for dem at flygte ind i gasfasen, hvilket fører til dens lavere volatilitet sammenlignet med carbontetrachlorid.
Sidste artikelHvilke husholdningsprodukter indeholder chlorid?
Næste artikelHvad sker der, når kulstof reagerer med brom?
 Varme artikler
Varme artikler
-
 En lovende strategi til at øge aktiviteten i antimikrobielle peptiderKredit:Institut national de la recherche scientifique I en artikel offentliggjort for nylig i Plos One , forskere fra INRS-Institut Armand-Frappier Research Center rapporterede en strategi, der
En lovende strategi til at øge aktiviteten i antimikrobielle peptiderKredit:Institut national de la recherche scientifique I en artikel offentliggjort for nylig i Plos One , forskere fra INRS-Institut Armand-Frappier Research Center rapporterede en strategi, der -
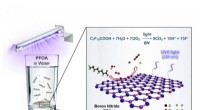 Bornitrid ødelægger for evigt kemikalier PFOA, GenXEn illustration af bornitrid-fotokatalyse, der ødelægger det forurenende stof PFOA i vand. Kredit:Billede udlånt af M. Wong/Rice University Rice University kemiingeniører fandt en effektiv katalys
Bornitrid ødelægger for evigt kemikalier PFOA, GenXEn illustration af bornitrid-fotokatalyse, der ødelægger det forurenende stof PFOA i vand. Kredit:Billede udlånt af M. Wong/Rice University Rice University kemiingeniører fandt en effektiv katalys -
 Svamp producerer yderst effektivt overfladeaktivt stofDr. Markus Greßler (l.) Og Florian Baldeweg undersøger en kultur af svampen Mortierella alpina. Jena -forskerne var i stand til at bevise, at svampen producerer store mængder af et overfladeaktivt sto
Svamp producerer yderst effektivt overfladeaktivt stofDr. Markus Greßler (l.) Og Florian Baldeweg undersøger en kultur af svampen Mortierella alpina. Jena -forskerne var i stand til at bevise, at svampen producerer store mængder af et overfladeaktivt sto -
 Elektrokemiske celler høster lithium fra havvandKAUST-forskere har udviklet en metode til at udvinde lithium, et vigtigt element i batterier til autonome køretøjer, fra havvand på en mere økonomisk rentabel måde. Kredit:Morgan Bennett Smith Lit
Elektrokemiske celler høster lithium fra havvandKAUST-forskere har udviklet en metode til at udvinde lithium, et vigtigt element i batterier til autonome køretøjer, fra havvand på en mere økonomisk rentabel måde. Kredit:Morgan Bennett Smith Lit
- Billede:Pandora, den blivende perturber
- Når to kroppe kolliderer, hvorfor gør de støj?
- Metamaterialekimærer, der næsten ikke kan påvises på tværs af synligt lys, mikrobølger og infr…
- Hvorfor stjerner Gas Giant Planets?
- Hvad er trinene i rockcyklus, hvis det starter med sedimentært trækkes ind i det indre af tektonis…
- Hvad hedder det videnskabelige lovlufttryk og volumen?


