Hvilken egenskab ved vand opløser bordsalt?
* vand er et polært molekyle: Oxygenatomet i vand har en lidt negativ ladning, mens brintatomerne har en lidt positiv ladning. Denne ujævne fordeling af ladning skaber et dipolmoment, hvilket gør vand til et polært molekyle.
* Tabel salt (NaCl) er en ionisk forbindelse: Natriumchlorid er sammensat af positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-). Disse ioner holdes sammen af stærke elektrostatiske kræfter.
* polær opløser polær: Når vandmolekyler støder på bordsalt, tiltrækkes de positivt ladede brintender af vandmolekyler de negativt ladede chloridioner, mens de negativt ladede iltender tiltrækkes af de positivt ladede natriumioner.
* Hydrering: Denne attraktion bryder de ioniske bindinger, der holder saltet sammen, og de individuelle ioner bliver omgivet af vandmolekyler. Denne proces, kaldet hydrering, opløses effektivt saltet.
Så vandets polaritet tillader det at danne stærke attraktioner med de ladede ioner i bordsalt, bryde dem fra hinanden og opløste saltet.
Sidste artikelDe faste stoffer aluminium og svovl reagerer for at producere sulfid?
Næste artikelHar benzin benzen i det?
 Varme artikler
Varme artikler
-
 Neutroner optimerer højeffektiv katalysator for en grønnere tilgang til biobrændstofsynteseIllustration af den optimerede zeolitkatalysator (NbAlS-1), som muliggør en højeffektiv kemisk reaktion for at skabe buten, en vedvarende energikilde, uden at bruge store mængder energi til konverteri
Neutroner optimerer højeffektiv katalysator for en grønnere tilgang til biobrændstofsynteseIllustration af den optimerede zeolitkatalysator (NbAlS-1), som muliggør en højeffektiv kemisk reaktion for at skabe buten, en vedvarende energikilde, uden at bruge store mængder energi til konverteri -
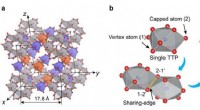 Gennembrud mod løsning af glasets strukturelle mysterium(a) Røde kugler er Pd- og Ni -atomer, hvorimod de blå kugler repræsenterer P -atomer. Den orangefarvede polyeder repræsenterer den Pd-berigede lille klynge, og det blåfarvede polyeder repræsenterer de
Gennembrud mod løsning af glasets strukturelle mysterium(a) Røde kugler er Pd- og Ni -atomer, hvorimod de blå kugler repræsenterer P -atomer. Den orangefarvede polyeder repræsenterer den Pd-berigede lille klynge, og det blåfarvede polyeder repræsenterer de -
 Spyttest for cannabis kan en dag hjælpe med at identificere handicappede bilisterEn ny enhed kan en dag blive brugt til at opdage marihuanaforgiftning ved vejkanter. Kredit:Shalini Prasad I USA, de, der indtager alkohol og kører bil, bliver ofte udsat for standsninger ved veje
Spyttest for cannabis kan en dag hjælpe med at identificere handicappede bilisterEn ny enhed kan en dag blive brugt til at opdage marihuanaforgiftning ved vejkanter. Kredit:Shalini Prasad I USA, de, der indtager alkohol og kører bil, bliver ofte udsat for standsninger ved veje -
 Detaljeret billede afslører, hvordan tandemaljen er stærk nok til at holde livet udPIC -kortlægning, som måler biominerale krystalorienteringer og tildeler forskellige farver til forskellige rotationsvinkler, afslører, at krystallerne i tandemaljen ikke er perfekt justeret. Kredit:P
Detaljeret billede afslører, hvordan tandemaljen er stærk nok til at holde livet udPIC -kortlægning, som måler biominerale krystalorienteringer og tildeler forskellige farver til forskellige rotationsvinkler, afslører, at krystallerne i tandemaljen ikke er perfekt justeret. Kredit:P
- Hvorfor er det, at den runde oversigt over Moon undertiden kan ses i en ny eller cresant -fase?
- Sport er ikke din ting? Streamingindstillinger fra Philo er måske noget for dig
- Bylandbrug:fire grunde til, at det bør blomstre efter pandemien
- Når en tværgående bølge bevæger sig gennem medium, hvilken vej betyder noget i farten?
- Tager farven rød i solenergi?
- Hvad er forskellen mellem carbonatom og nitrogenatom?


