Et bromatom ville danne sin mest stabile ion ved?
Her er hvorfor:
* Elektronkonfiguration: Brom har 35 elektroner. Dens elektronkonfiguration er [AR] 3D 10 4S 2 4p 5 . Dette betyder, at det har 7 elektroner i sin yderste skal (Valence Shell).
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med 8 elektroner i deres yderste skal (oktetreglen).
* ionisk bindingsdannelse: Brom er en elektron, der ikke har en fuld oktet. Ved at få en elektron bliver det en bromidion (BR - ) med den stabile elektronkonfiguration af den ædle gas krypton ([AR] 3D 10 4S 2 4p 6 ).
Derfor danner brom let en stabil ion ved at acceptere en elektron til at blive en negativt ladet bromidion (BR - ).
Sidste artikelHvorfor reagerer manganoxid med hydrogenperoxid?
Næste artikelHvilke har bindinger, der er mest polære SCL2 F2 CS2 CF4 BRCL?
 Varme artikler
Varme artikler
-
 Materialer kan føre til selvhelbredende smartphonesEt nyt materiale helbreder ikke kun sig selv, men den strækker sig også op til 50 gange sin sædvanlige størrelse; disse egenskaber kan reparere din telefons batteri, hvis det revner, eller forhindre d
Materialer kan føre til selvhelbredende smartphonesEt nyt materiale helbreder ikke kun sig selv, men den strækker sig også op til 50 gange sin sædvanlige størrelse; disse egenskaber kan reparere din telefons batteri, hvis det revner, eller forhindre d -
 En grønnere vej til blå:Ny metode reducerer drastisk mængden af opløsningsmiddel, der er nødv…Udvikling af farvestofdannelse i løbet af 48 timers reaktionstid, efter opløsning af samme mængde faststof i samme mængde opløsningsmiddel. Kredit:Aalto University/Sandra Kaabel Phthalocyaniner bru
En grønnere vej til blå:Ny metode reducerer drastisk mængden af opløsningsmiddel, der er nødv…Udvikling af farvestofdannelse i løbet af 48 timers reaktionstid, efter opløsning af samme mængde faststof i samme mængde opløsningsmiddel. Kredit:Aalto University/Sandra Kaabel Phthalocyaniner bru -
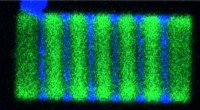 Ny klasse af bløde halvledere kunne transformere HD-skærmeEn 2-D plade, der viser skiftevis cæsium blychlorid (blå) og cæsium blybromid (grøn) segmenter. Kredit:Letian Dou/Berkeley Lab og Connor G. Bischak/UC Berkeley En ny type halvleder kan være på vej
Ny klasse af bløde halvledere kunne transformere HD-skærmeEn 2-D plade, der viser skiftevis cæsium blychlorid (blå) og cæsium blybromid (grøn) segmenter. Kredit:Letian Dou/Berkeley Lab og Connor G. Bischak/UC Berkeley En ny type halvleder kan være på vej -
 Forskere gør plastik mere nedbrydeligt under UV-lysKredit:Unsplash/CC0 Public Domain Mange plastiktyper, der er mærket som biologisk nedbrydelige, er kun komposterbare under industrielle forhold, men forskere ved University of Bath har nu fundet en
Forskere gør plastik mere nedbrydeligt under UV-lysKredit:Unsplash/CC0 Public Domain Mange plastiktyper, der er mærket som biologisk nedbrydelige, er kun komposterbare under industrielle forhold, men forskere ved University of Bath har nu fundet en
- Hvilken form for energi er repræsenteret af en bog, der falder ned på skrivebordet?
- Et nærmere kig på, hvad der forårsagede Flint-vandkrisen
- Kemisk formel til propan
- Hvordan beregnes procent udbytte?
- Hvad er produceret af en blomst, der til sidst bliver ny plante?
- Bør FEMA anerkende ekstrem varme og skovbrandrøg som 'større katastrofer?'


