Hvorfor er hydrogenchlorid en gas ved stuetemperatur og tryk?
* svage intermolekylære kræfter: HCL-molekyler holdes sammen af svage dipol-dipol-interaktioner. Dette skyldes, at molekylet har et permanent dipolmoment på grund af forskellen i elektronegativitet mellem brint og klor. Imidlertid er disse kræfter meget svagere end den stærkere hydrogenbinding, der findes i vand, for eksempel.
* lav molekylvægt: HCI har en relativt lav molekylvægt (36,46 g/mol). Dette betyder, at molekylerne er relativt lette og kan bevæge sig frit ved stuetemperatur.
* lille størrelse: HCL -molekylet er lille, hvilket yderligere bidrager til de svage intermolekylære kræfter og molekylernes evne til at bevæge sig frit.
Kortfattet: Kombinationen af svage intermolekylære kræfter, lav molekylvægt og lille størrelse af HCL -molekylet resulterer i en gasformig tilstand ved stuetemperatur og tryk.
Bemærk: HCI kan opløses i vand til dannelse af saltsyre, en stærk syre. I denne opløsning er HCL -molekylerne omgivet af vandmolekyler, og de intermolekylære kræfter er stærkere, hvilket fører til en flydende tilstand.
 Varme artikler
Varme artikler
-
 En mere effektiv, sikrere alternativ til at skaffe kobber via bakterierKredit:Pixabay/CC0 Public Domain Kobber er stadig et af de mest allestedsnærværende metaller i hverdagen. Som en leder af varme og elektricitet, det bruges i ledninger, tagdækning og VVS, samt en
En mere effektiv, sikrere alternativ til at skaffe kobber via bakterierKredit:Pixabay/CC0 Public Domain Kobber er stadig et af de mest allestedsnærværende metaller i hverdagen. Som en leder af varme og elektricitet, det bruges i ledninger, tagdækning og VVS, samt en -
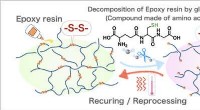 Ny strategi til fremme af genbrug af kulfiberforstærket plastFigur 1:Genbrugssystem af epoxyharpiks med peptidopløsning. Kredit:National Institute for Materials Science Epoxyharpiks er en type termohærdende harpiks, der almindeligvis anvendes i lim, maling
Ny strategi til fremme af genbrug af kulfiberforstærket plastFigur 1:Genbrugssystem af epoxyharpiks med peptidopløsning. Kredit:National Institute for Materials Science Epoxyharpiks er en type termohærdende harpiks, der almindeligvis anvendes i lim, maling -
 Hvad er grøn tørrensning? En giftstofekspert forklarerVed du, hvad dit tøj har været i blød i? Kredit:ET1972/Shutterstock Vinterferien er en travl tid for mange virksomheder, herunder detailbutikker, købmænd, spiritusforretninger - og renserier. Folk
Hvad er grøn tørrensning? En giftstofekspert forklarerVed du, hvad dit tøj har været i blød i? Kredit:ET1972/Shutterstock Vinterferien er en travl tid for mange virksomheder, herunder detailbutikker, købmænd, spiritusforretninger - og renserier. Folk -
 Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil
Revner i perovskitfilm til solceller kan let heles, undersøgelse finderEn revnet perovskitfilm (til venstre) kan heles fuldstændigt (højre) med en vis komprimering af lidt varme, ny forskning viser. Resultaterne lover godt for den langsigtede pålidelighed af perovskitfil
- Hvordan fortynding af ouzo spiritus kunne føre til bedre emulsioner
- Hvilke ændrer sig omkring en bølge, når den går fra et medium til et andet?
- Florida mangrover afslører komplekse forhold mellem klima og naturlige systemer
- Strømme påvirker hvad med nærliggende landmasser?
- Hvad er energien fra foton?
- Hvad sker der med et stof, der gennemgår termisk energi?


