Hvorfor er natriumhydroxid forurenet med carbonat?
Kemien:
* natriumhydroxid er hygroskopisk: Dette betyder, at det let absorberer fugt fra luften.
* kuldioxid i luften: Atmosfæren indeholder kuldioxid.
* reaktion: Når natriumhydroxid absorberer fugt, danner det en vandig opløsning. Denne opløsning reagerer derefter med kuldioxid for at danne natriumcarbonat og vand:
2NAOH (AQ) + CO2 (G) → NA2CO3 (AQ) + H2O (L)
Konsekvenser af carbonatforurening:
* Nedsat renhed: Tilstedeværelsen af natriumcarbonat sænker renheden af natriumhydroxid.
* påvirkede reaktioner: Tilstedeværelsen af carbonationer kan forstyrre kemiske reaktioner, hvilket fører til uventede resultater eller bivirkninger.
* pH -ændringer: Natriumcarbonat er basisk, men mindre end natriumhydroxid. Dette kan påvirke pH af opløsninger og påvirke reaktioner.
Minimering af forurening:
* opbevaring: Natriumhydroxid skal opbevares i lufttætte containere for at minimere eksponering for fugt og kuldioxid.
* Håndtering: Håndtering af natriumhydroxid i et tørt, godt ventileret område kan hjælpe med at reducere forurening.
* Forberedelse: Opløsninger af natriumhydroxid kan fremstilles ved hjælp af frisk kogt, afkølet vand til at fjerne opløst kuldioxid.
I resuméet er forurening af natriumhydroxid med natriumcarbonat et resultat af dets reaktion med kuldioxid i atmosfæren på grund af dets hygroskopiske natur. Dette kan påvirke renheden og reaktiviteten af natriumhydroxid, hvilket gør det vigtigt at overveje og minimere denne forurening.
Sidste artikelHvad er formlen, når du limning af kulstof og klor?
Næste artikelHvorfor er hydrogenchlorid en gas ved stuetemperatur og tryk?
 Varme artikler
Varme artikler
-
 Nyligt udviklet enzym fremskynder langsom organisk reaktionKredit:SUWIT NGAOKAEW, Shutterstock Alsidige katalysatorer med nye funktioner og funktioner kan revolutionere videnskabsmænds syntetiske strategier og bane vejen for kemikalier af høj værdi og en g
Nyligt udviklet enzym fremskynder langsom organisk reaktionKredit:SUWIT NGAOKAEW, Shutterstock Alsidige katalysatorer med nye funktioner og funktioner kan revolutionere videnskabsmænds syntetiske strategier og bane vejen for kemikalier af høj værdi og en g -
 Biokemisk superlim åbner en ny tilgang til vaccineudviklingKredit:University of Oxford Et spinoutfirma fra Oxford University er ved at udvikle en molekylær superlim til hurtig udvikling af vacciner rettet mod en række sygdomme. SpyBiotech bruger biokemis
Biokemisk superlim åbner en ny tilgang til vaccineudviklingKredit:University of Oxford Et spinoutfirma fra Oxford University er ved at udvikle en molekylær superlim til hurtig udvikling af vacciner rettet mod en række sygdomme. SpyBiotech bruger biokemis -
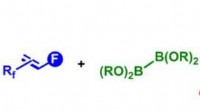 Kemikere frigør potentialet for fluoralkenerSyntesevej til forskellige fluoralkener via defluorborylering af polyfluoralkener. Kredit:© 2017 Osaka University, RIKEN, og Tokyo Medical and Dental University En af de stærkeste kemiske bindinge
Kemikere frigør potentialet for fluoralkenerSyntesevej til forskellige fluoralkener via defluorborylering af polyfluoralkener. Kredit:© 2017 Osaka University, RIKEN, og Tokyo Medical and Dental University En af de stærkeste kemiske bindinge -
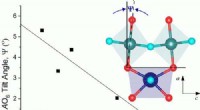 Opbygning af viden om ændringer i urankemiKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Der er stadig rigtig mange spørgsmål, der skal besvares inden for urankemi, især i forbindelse med det nukleare brændselskreds
Opbygning af viden om ændringer i urankemiKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Der er stadig rigtig mange spørgsmål, der skal besvares inden for urankemi, især i forbindelse med det nukleare brændselskreds
- Hvordan stammer udtrykket aromatiske forbindelser?
- Har lavalamper og faktiske lignende egenskaber?
- Hvad er videnskabelig tænkning baseret på?
- Hunde, hvordan krig fungerer
- Hvad var støvdæmpningseffekten?
- At vurdere risikoen for kemikalier for dyrelivet er en kæmpe udfordring, der kræver en ny tilgang


