Hvad er elektronkonfigurationen af svovl langhåndsversion?
1S² 2S² 2P⁶ 3S² 3P⁴
Forklaring:
* 1S²: Det første energiniveau (n =1) har et underskal, 'S' underskalet, der kan holde op til 2 elektroner.
* 2s²: Det andet energiniveau (n =2) har to underskaller, 'S' og 'P'. Subshellet 's' har 2 elektroner.
* 2p⁶: Underskalet 'P' i det andet energiniveau kan indeholde op til 6 elektroner.
* 3S²: Det tredje energiniveau (n =3) har også 's' og 'p' underskaller. Subshellet 's' har 2 elektroner.
* 3p⁴: Underskalet 'P' i det tredje energiniveau er delvist fyldt med 4 elektroner.
Vigtig note: Denne konfiguration repræsenterer jordtilstanden for et neutralt svovlatom. Elektronkonfigurationen af ioner vil være anderledes.
Sidste artikelRepresenterer Kolbe -formlen en forbindelse?
Næste artikelHvilken er større silicium eller svovl?
 Varme artikler
Varme artikler
-
 Edderkoppesilke:Et formbart protein giver forstærkningFiguren viser et edderkoppespind sammen med den undersøgte domænes molekylære struktur i bunden tilstand i overfladerepræsentation (struktur i rød/orange, øverste venstre hjørne). Aminosyrens methioni
Edderkoppesilke:Et formbart protein giver forstærkningFiguren viser et edderkoppespind sammen med den undersøgte domænes molekylære struktur i bunden tilstand i overfladerepræsentation (struktur i rød/orange, øverste venstre hjørne). Aminosyrens methioni -
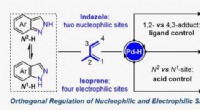 Ortogonal reguleringsstrategi giver nye muligheder for opbygning af molekylær kompleksitetPd-katalytisk regiodivergent dimethylallylering af indazol med isopren. Kredit:JIANG Wenshuang og JI Dingwei Dimethylallyl-relaterede enheder spiller en væsentlig rolle i at øge lipofilicitet af m
Ortogonal reguleringsstrategi giver nye muligheder for opbygning af molekylær kompleksitetPd-katalytisk regiodivergent dimethylallylering af indazol med isopren. Kredit:JIANG Wenshuang og JI Dingwei Dimethylallyl-relaterede enheder spiller en væsentlig rolle i at øge lipofilicitet af m -
 Hurtige tests til tidlig diagnose af hjerteanfald og identifikation af sepsisHøjpræcisionsautomatisk dispenser til præcis påføring af specifikke reagenser. Kredit:©NUST MISIS NUST MISIS-forskere har udviklet en ny type membranteststrimmel til en kvantitativ immunokromatogr
Hurtige tests til tidlig diagnose af hjerteanfald og identifikation af sepsisHøjpræcisionsautomatisk dispenser til præcis påføring af specifikke reagenser. Kredit:©NUST MISIS NUST MISIS-forskere har udviklet en ny type membranteststrimmel til en kvantitativ immunokromatogr -
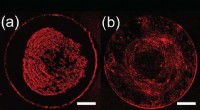 Ny fremstillingsteknik kan forbedre det almindelige problem inden for printteknologiFor figur A, der er partikeltransport til spidsen af måldråben, og der dannes en tæt midteraflejring. For figur B, den endelige kortlagte indbetaling er mere ensartet. Kredit: Langmuir En ny fr
Ny fremstillingsteknik kan forbedre det almindelige problem inden for printteknologiFor figur A, der er partikeltransport til spidsen af måldråben, og der dannes en tæt midteraflejring. For figur B, den endelige kortlagte indbetaling er mere ensartet. Kredit: Langmuir En ny fr
- Hvad er opvarmning af land og vand?
- Hvordan bevæger en gratis elektron i hvile sig i et elektrisk felt?
- Nye syntetiske biologiværktøjer låser op for kompleks anlægsteknik
- Hvad er et eksempel for bølger overfører energi ikke betyder noget?
- Hvad er et stof, der ikke leder?
- Vådområder vil følge med havniveaustigningen for at opveje klimaændringer


