Elementer, der let mister elektroner for at danne positive ioner?
Her er nogle egenskaber ved metaller:
* lav ioniseringsenergi: Dette betyder, at de let mister elektroner for at blive positivt ladede ioner (kationer).
* Lav elektronegativitet: Dette betyder, at de har en svag attraktion for elektroner.
* gode ledere af varme og elektricitet: På grund af den lethed, hvorpå elektroner kan bevæge sig inden for deres strukturer.
* formbar og duktil: De kan formes og trækkes ind i ledninger.
* skinnende og skinnende: De reflekterer let godt.
Eksempler på metaller, der let mister elektroner:
* gruppe 1 (alkalimetaller): Lithium (Li), natrium (NA), kalium (K), Rubidium (RB), Cesium (CS) og Francium (FR). Disse elementer har kun en valenselektron, som de let mister til dannelse af +1 ioner.
* gruppe 2 (alkaliske jordmetaller): Beryllium (BE), magnesium (Mg), calcium (CA), strontium (SR), barium (BA) og radium (RA). Disse elementer har to valenselektroner, som de let mister til dannelse af +2 ioner.
* Overgangsmetaller: Mange overgangsmetaller mister også let elektroner til dannelse af ioner, men deres ladninger kan variere afhængigt af det specifikke element og dets kemiske miljø. Eksempler inkluderer jern (Fe), kobber (Cu), zink (Zn) og guld (AU).
Det er vigtigt at huske, at tendensen til at miste elektroner ikke er absolut. Selv inden for en gruppe kan reaktiviteten af metaller variere afhængigt af faktorer som atomstørrelse og nuklear ladning.
 Varme artikler
Varme artikler
-
 Unikke dendritiske klæbrige partikler dannet ved at udnytte flydende kaosNC State forskere bruger en kaotisk teknik til at skabe ordnede partikler med klæbrige egenskaber. Kredit:Orlin Velev, NC State University Ny forskning fra North Carolina State University viser, a
Unikke dendritiske klæbrige partikler dannet ved at udnytte flydende kaosNC State forskere bruger en kaotisk teknik til at skabe ordnede partikler med klæbrige egenskaber. Kredit:Orlin Velev, NC State University Ny forskning fra North Carolina State University viser, a -
 Nyudviklet is-afstødende belægning er 100 gange stærkere end andreKredit:Unsplash/CC0 Public Domain En maskiningeniør fra University of Houston har udviklet et sprøjtbart is-udskillende materiale, der er 100 gange stærkere end noget andet. Det nye holdbare belægn
Nyudviklet is-afstødende belægning er 100 gange stærkere end andreKredit:Unsplash/CC0 Public Domain En maskiningeniør fra University of Houston har udviklet et sprøjtbart is-udskillende materiale, der er 100 gange stærkere end noget andet. Det nye holdbare belægn -
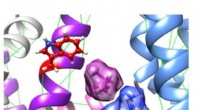 Forskere opdager molekylære mekanismer af gamle naturlægemidlerComputermodel af de to urtekomponenter, et isovalerinsyremolekyle (violet, øverst til venstre) og mallotoksin (blå, nederst til højre), optager tilstødende bindingssteder for synergistisk at aktivere
Forskere opdager molekylære mekanismer af gamle naturlægemidlerComputermodel af de to urtekomponenter, et isovalerinsyremolekyle (violet, øverst til venstre) og mallotoksin (blå, nederst til højre), optager tilstødende bindingssteder for synergistisk at aktivere -
 Skaber mere bæredygtige dufte med bioteknologiKredit:Pixabay/CC0 Public Domain I lyset af et skiftende klima og afgrødesygdomme, Producenter af produkter, der indeholder naturlige smags- og duftstoffer, går over til en ny måde at skaffe ingre
Skaber mere bæredygtige dufte med bioteknologiKredit:Pixabay/CC0 Public Domain I lyset af et skiftende klima og afgrødesygdomme, Producenter af produkter, der indeholder naturlige smags- og duftstoffer, går over til en ny måde at skaffe ingre
- Hvilken slags energi er involveret i at tænde for et tv -sæt?
- Hvilken slags sten eller jord er uigennemtrængelig ved vand?
- Italienske astronomer opdager en ny stjernehob
- Mænd villige til at straffe mere end kvinder for at komme videre
- Hvorfor er vand en væske ved stuetemperatur, hvorimod ammoniakgasstemperatur?
- Hvor langt væk er månen fra jorden i lysår?


