Hvorfor producerer 1 mol NaCl en større ændring i de kolligative egenskaber vand end saccharose?
Kolligative egenskaber og dissociation
Kolligative egenskaber er egenskaber ved løsninger, der afhænger af * -nummeret * af de tilstedeværende opløste partikler, ikke deres kemiske identitet. Disse egenskaber inkluderer:
* damptryk sænkning: Damptrykket af en opløsning er lavere end for det rene opløsningsmiddel.
* kogepunkthøjde: Kogepunktet for en opløsning er højere end for det rene opløsningsmiddel.
* frysningspunktdepression: Frysningspunktet for en opløsning er lavere end for det rene opløsningsmiddel.
* osmotisk tryk: Det krævede tryk for at forhindre strømmen af opløsningsmiddel på tværs af en semipermeabel membran.
ioniske vs. molekylære forbindelser
* NaCl (natriumchlorid): En ionisk forbindelse, der adskiller sig fuldstændigt i dens ioner, når de opløses i vand. En mol NaCI producerer 2 mol ioner (1 mol Na+ og 1 mol CL-).
* Sucrose (C12H22O11): En molekylær forbindelse, der ikke adskiller sig i ioner, når de opløses i vand. En mol saccharose forbliver som en mol molekyler.
Virkningen på kolligative egenskaber
Da NaCl adskiller sig i flere partikler end saccharose, har det en større effekt på kolligative egenskaber. Her er hvorfor:
* flere partikler, større ændring: Ændringen i kolligative egenskaber er direkte proportional med antallet af opløste partikler. Flere partikler i opløsning fører til en større ændring i damptryk, kogepunkt, frysepunkt og osmotisk tryk.
* Van't Hoff Factor: Van't Hoff -faktoren (I) tegner sig for antallet af partikler, som en opløst stof producerer i opløsning. For NaCl, i =2; For sucrose, i =1.
Eksempel:Frysningspunktdepression
Lad os overveje at frysepunkt depression:
* En 1 molal opløsning af NaCI vil have en frysepunktdepression dobbelt så stor som en 1 molal opløsning af saccharose, fordi NaCl producerer dobbelt så mange partikler.
Kortfattet
NaCl på grund af dens ioniske natur og komplette dissociation producerer flere partikler i opløsning end saccharose. Denne højere partikelkoncentration fører til en større ændring i kolligative egenskaber.
 Varme artikler
Varme artikler
-
 Udvikling af et nyt spin til sygdomsdiagnostikμCENSE-chip med centrifugalplatformen på bænken i baggrunden. Kredit:Joo Chuan Yeo Forskere ved National University of Singapore har skabt en ny platform med potentiale til at udvinde små cirkuler
Udvikling af et nyt spin til sygdomsdiagnostikμCENSE-chip med centrifugalplatformen på bænken i baggrunden. Kredit:Joo Chuan Yeo Forskere ved National University of Singapore har skabt en ny platform med potentiale til at udvinde små cirkuler -
 Video:Hvorfor er vestkysten himmelorange?Kredit:The American Chemical Society Californiens skovbrande er, desværre, intet nyt - men det er den lyse orange himmel bestemt. Denne uge om reaktioner, vi taler med eksperter, der forklarer år
Video:Hvorfor er vestkysten himmelorange?Kredit:The American Chemical Society Californiens skovbrande er, desværre, intet nyt - men det er den lyse orange himmel bestemt. Denne uge om reaktioner, vi taler med eksperter, der forklarer år -
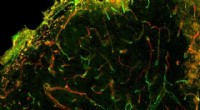 Injicerbar gel lover som sårhelende materiale til slagtilfældeEt fluorescens-forstærket mikroskopbillede, der viser sundt udseende blodkarvækst efter slagtilfælde, i en mus. Kredit:UCLA Et forskerhold ledet af UCLA biomolekylære ingeniører og læger har demon
Injicerbar gel lover som sårhelende materiale til slagtilfældeEt fluorescens-forstærket mikroskopbillede, der viser sundt udseende blodkarvækst efter slagtilfælde, i en mus. Kredit:UCLA Et forskerhold ledet af UCLA biomolekylære ingeniører og læger har demon -
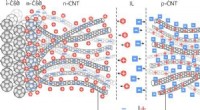 Forskere opdager overkommelig metode til produktion af transparente solcellerIonisk lukket lille-molekyle opv:grænseflade-doping af ladningssamler og transportlag. Kredit: ACS -anvendte materialer og grænseflader (2021). DOI:10.1021/acsami.0c17865 Fysikere fra ITMO Univ
Forskere opdager overkommelig metode til produktion af transparente solcellerIonisk lukket lille-molekyle opv:grænseflade-doping af ladningssamler og transportlag. Kredit: ACS -anvendte materialer og grænseflader (2021). DOI:10.1021/acsami.0c17865 Fysikere fra ITMO Univ
- Tesla ruster op til fuldt selvkørende biler midt i skepsis (Opdatering)
- Brændte bygninger afslører plyndringen af den gamle tyrkiske by 3, 500 år siden
- Hvad kollapser en stjerne i, når dens elementer dør?
- Arizona lider af flere store naturbrande
- Hvad er fordelen ved vindkraft i forhold til atomkraft?
- Hvilket metal har den specifikke varme på 0,30?


