Hvad er den molekylære formel for kobberacetat?
Her er en sammenbrud:
* kobber (I) acetat: Cuch₃coo
* kobber (II) acetat: Cu (ch₃coo) ₂
Forklaring:
* kobber (i) Har en +1 -opladning (CU⁺).
* kobber (ii) har en +2 ladning (cu²⁺).
* acetat har en -1 -afgift (ch₃coo⁻).
For at afbalancere ladningerne i forbindelsen, har du brug for:
* Ét kobber (i) ion (Cu⁺) og en acetation (ch₃coo⁻) til dannelse af cuch₃coo .
* En kobber (II) ion (Cu²⁺) og to acetationer (ch₃coo⁻) til dannelse af cu (ch₃coo) ₂ .
Bemærk: Kobber (II) Acetat er meget mere almindeligt end kobber (I) acetat.
 Varme artikler
Varme artikler
-
 Bæredygtigt læder, garn og papir – fra brødspisende svampeSvampefibre kan omdannes til garn (venstre) eller en lædererstatning (højre). Kredit:Akram Zamani Din næste trendy håndtaske kunne være lavet af læder lavet af en svamp. I dag vil forskere beskrive
Bæredygtigt læder, garn og papir – fra brødspisende svampeSvampefibre kan omdannes til garn (venstre) eller en lædererstatning (højre). Kredit:Akram Zamani Din næste trendy håndtaske kunne være lavet af læder lavet af en svamp. I dag vil forskere beskrive -
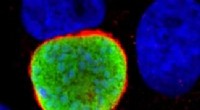 Malaria kaprer dine gener for at invadere din leverI de tidlige stadier af infektion, malariaparasitten (grøn) gemmer sig i en persons leverceller (blå), før den invaderer deres blod. Vist med rødt er et menneskeligt protein, som parasitten co-opterer
Malaria kaprer dine gener for at invadere din leverI de tidlige stadier af infektion, malariaparasitten (grøn) gemmer sig i en persons leverceller (blå), før den invaderer deres blod. Vist med rødt er et menneskeligt protein, som parasitten co-opterer -
 At se stivelse:Ny teknik muliggør skånsom observation af biobrændstofmaterialerMens jeg udforskede poppelceller ved hjælp af et scannende elektronmikroskop, forskere observerede sæklignende strukturer, vist i lilla, der senere blev identificeret som stivelse gennem Raman -spektr
At se stivelse:Ny teknik muliggør skånsom observation af biobrændstofmaterialerMens jeg udforskede poppelceller ved hjælp af et scannende elektronmikroskop, forskere observerede sæklignende strukturer, vist i lilla, der senere blev identificeret som stivelse gennem Raman -spektr -
 En naturligt inspireret, genanvendeligt system, der renser vand og bygger sig selvEt nyt materiale udviklet af forskere fra Penn State kunne en dag bruges til at fjerne vedvarende forurenende stoffer fra drikkevand. Kredit:ISTOCK/@HYRMA I naturen, interaktionen mellem molekyler
En naturligt inspireret, genanvendeligt system, der renser vand og bygger sig selvEt nyt materiale udviklet af forskere fra Penn State kunne en dag bruges til at fjerne vedvarende forurenende stoffer fra drikkevand. Kredit:ISTOCK/@HYRMA I naturen, interaktionen mellem molekyler
- Hvad er konstruktion af bevægende spiralballistisk galvanometer?
- Nigerianske bagerier har brug for støtte til at skifte til ren energi, siger forskere
- Liste over ideer til videnskabelige fairprojekter for mellemskolen
- Hvilke mineraler udvindes i U.A.E?
- Hvad er et mørkt stofmikroskop, der bruges til?
- Sådan skaber du smart city-teknologi med tilsluttede biler


