Hvilke oxider er sure, og hvilken grundlæggende?
Generelle regler:
* metaloxider (undtagen for nogle overgangsmetaller) har en tendens til at være grundlæggende .
* Ikke-metaloxider har en tendens til at være sur .
* overgangsmetaloxider Kan være sure, basale eller amfoteriske (fungerer som både en syre og en base) afhængigt af metalens oxidationstilstand og de specifikke tilstande.
Forklaringer:
* Grundlæggende oxider: Når metaloxider reagerer med vand, danner de hydroxider (OH-), som er baser. For eksempel:
* Na₂o + H₂O → 2NAOH (natriumhydroxid)
* CAO + H₂O → CA (OH) ₂ (calciumhydroxid)
* Sure oxider: Ikke-metaloxider reagerer med vand for at danne syrer. For eksempel:
* SO₂ + H₂O → H₂SO₃ (svovlsyre)
* CO₂ + H₂O → H₂CO₃ (kulsyre)
* amfoteriske oxider: Nogle oxider, især dem med overgangsmetaller, kan fungere som både syrer og baser. For eksempel:
* Al₂o₃ kan reagere med både syrer og baser:
* Al₂o₃ + 6HCl → 2Alcl₃ + 3H₂O (sur reaktion)
* Al₂o₃ + 2NAOH + 3H₂O → 2NA [AL (OH) ₄] (grundlæggende reaktion)
Eksempler:
* Sure oxider: Co₂, so₂, n₂o₅, p₄o₁₀
* Grundlæggende oxider: Na₂o, K₂O, CAO, MGO
* amfoteriske oxider: Al₂o₃, Zno, Cr₂o₃
Faktorer, der påvirker surhed/basicitet:
* Elektronegativitet: Ikke-metaller har højere elektronegativitet end metaller. Dette gør dem mere tilbøjelige til at tiltrække elektroner og danne sure oxider.
* Oxidationstilstand: Til overgangsmetaller fører en højere oxidationstilstand ofte til et mere surt oxid.
Nøglepunkt: At forstå disse generelle regler og principper vil hjælpe dig med at forudsige den sure eller basale karakter af de fleste oxider. Husk, at der findes undtagelser, så vær altid forsigtig og henvis til specifikke kemiske egenskaber, når det er nødvendigt.
 Varme artikler
Varme artikler
-
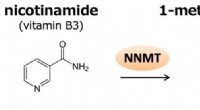 Søjlelignende molekyler som biosensorer for metabolitterNNMT katalyserer methyleringen af nikotinamid til fremstilling af 1-methylnicotinamid (1-MNA). 1-MNA kan yderligere oxideres af aldehydoxidase til, N1-methyl-2-pyridon-5-carboxamid (2py) eller N1-me
Søjlelignende molekyler som biosensorer for metabolitterNNMT katalyserer methyleringen af nikotinamid til fremstilling af 1-methylnicotinamid (1-MNA). 1-MNA kan yderligere oxideres af aldehydoxidase til, N1-methyl-2-pyridon-5-carboxamid (2py) eller N1-me -
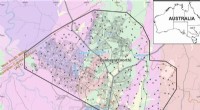 Identifikation af snavskilder til kriminel efterforskningKort over Canberra, viser placeringen af referenceprøver. Placering af test (blindede) prøver i blåt. Kredit:Patrice De Caritat Forskere har taget de første skridt i udviklingen af en ny metod
Identifikation af snavskilder til kriminel efterforskningKort over Canberra, viser placeringen af referenceprøver. Placering af test (blindede) prøver i blåt. Kredit:Patrice De Caritat Forskere har taget de første skridt i udviklingen af en ny metod -
 Forskere udvikler fleksibel krystal, baner vejen for mere effektiv bøjelig elektronikEt nærbillede af den nye piezoelektriske krystal udviklet af NTU -forskere, som kan bøje op til 40 gange mere end de konventionelle ferroelektriske krystaller, der typisk bruges i små aktuatorer og se
Forskere udvikler fleksibel krystal, baner vejen for mere effektiv bøjelig elektronikEt nærbillede af den nye piezoelektriske krystal udviklet af NTU -forskere, som kan bøje op til 40 gange mere end de konventionelle ferroelektriske krystaller, der typisk bruges i små aktuatorer og se -
 Kemikere varmer op til preprint-servereKredit:Charles Rondeau/public domain Preprint-servere – onlinewebsteder, der sender videnskabelige manuskripter gratis, forud for peer review-er veletablerede inden for områder som fysik og biolog
Kemikere varmer op til preprint-servereKredit:Charles Rondeau/public domain Preprint-servere – onlinewebsteder, der sender videnskabelige manuskripter gratis, forud for peer review-er veletablerede inden for områder som fysik og biolog
- Har pandemien fundamentalt ændret vores etik?
- En treløs slette, der er placeret i Arktis eller Antarktis og kendetegnet ved meget lave vintertemp…
- De forskellige enzymer i din krop overvejes hvilken gruppe af makromolekyler?
- Ny opdagelse finder, at sultende hvide dværge er spisespisende
- Optrævl nattehimlens mysterier med kunstig intelligens
- Hvad er objektivlinsens funktioner?


