Hvordan ligner selen svovl?
Ligheder:
* Elektronisk konfiguration: Både selen og svovl har seks valenselektroner, hvilket gør dem meget reaktive og tilbøjelige til at danne anioner med en -2 ladning (f.eks. S 2 - , Se 2- ).
* ikke -metaller: Begge er ikke -metaller, hvilket betyder, at de mangler metalliske egenskaber som ledningsevne og formbarhed.
* Lignende binding: De danner kovalente bindinger med andre ikke -metaller og ioniske bindinger med metaller.
* allotropes: Begge elementer findes i forskellige allotropiske former, hvilket betyder, at de kan have forskellige strukturelle arrangementer i deres solide tilstand. For eksempel eksisterer svovl som rhombisk og monoklinisk svovl, mens selen har amorfe og krystallinske former.
* Oxidation siger: Begge elementer udviser en lang række oxidationstilstande fra -2 til +6, hvilket giver dem mulighed for at deltage i forskellige kemiske reaktioner.
Der er dog også nogle vigtige forskelle:
* atomstørrelse: Selen er større end svovl på grund af tilstedeværelsen af en yderligere elektronskal. Denne størrelsesforskel kan påvirke deres reaktivitet og binding.
* Elektronegativitet: Selen er mindre elektronegativ end svovl, hvilket betyder, at det er mindre sandsynligt, at det tiltrækker elektroner i en binding.
* reaktivitet: Svovl er generelt mere reaktiv end selen.
* Biologiske roller: Selen er et essentielt mikronæringsstof for mange organismer, mens svovl er en vigtig komponent i proteiner og andre biomolekyler.
Kortfattet:
Selen og svovl er tæt beslægtede elementer på grund af deres lignende elektroniske konfiguration og position på den periodiske tabel. Imidlertid er deres atomstørrelse, elektronegativitet og reaktivitet forskellige, hvilket resulterer i forskellige kemiske og biologiske egenskaber.
 Varme artikler
Varme artikler
-
 Frysetørrede jordbær og is giver et meget stabilt forholdKredit:CC0 Public Domain ARS-forskere har vist, at nogle frysetørrede bærpulvere - især frysetørret jordbærpulver - kan fungere som fremragende stabilisatorer i is og andre frosne mejerideesserter
Frysetørrede jordbær og is giver et meget stabilt forholdKredit:CC0 Public Domain ARS-forskere har vist, at nogle frysetørrede bærpulvere - især frysetørret jordbærpulver - kan fungere som fremragende stabilisatorer i is og andre frosne mejerideesserter -
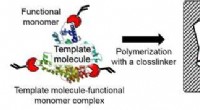 Meget følsom metode til at opdage potentiel cancerbiomarkørFigur 2:Koncept for molekylær prægningsteknologi. Kredit:Kobe University Exosomer regulerer intercellulær kommunikation i kræftformer, og henleder opmærksomheden som en potentiel kræftbiomarkør. E
Meget følsom metode til at opdage potentiel cancerbiomarkørFigur 2:Koncept for molekylær prægningsteknologi. Kredit:Kobe University Exosomer regulerer intercellulær kommunikation i kræftformer, og henleder opmærksomheden som en potentiel kræftbiomarkør. E -
 Hvordan forskere bekæmper infektionsfremkaldende biofilmEn kunstnerisk skildring af en biofilm med antibiotikaresistente stavformede og sfæriske bakterier. Kredit:Kateryna Kon/Shutterstock.com De overflader, mennesker interagerer med hver dag, kan virk
Hvordan forskere bekæmper infektionsfremkaldende biofilmEn kunstnerisk skildring af en biofilm med antibiotikaresistente stavformede og sfæriske bakterier. Kredit:Kateryna Kon/Shutterstock.com De overflader, mennesker interagerer med hver dag, kan virk -
 Forskere, der arbejder på at genvinde sjældne jordarters grundstoffer og sikre kritiske materialer…Forskere ved Oak Ridge National Laboratory kaster lys over kemiske separationer for at genvinde sjældne jordarters grundstoffer. Kredit:Ben Doughty/ORNL, U.S.A. Dept. of Energy Forskere ved Oak Rid
Forskere, der arbejder på at genvinde sjældne jordarters grundstoffer og sikre kritiske materialer…Forskere ved Oak Ridge National Laboratory kaster lys over kemiske separationer for at genvinde sjældne jordarters grundstoffer. Kredit:Ben Doughty/ORNL, U.S.A. Dept. of Energy Forskere ved Oak Rid
- Hvilken slags bølge bevæger sig partiklerne medium frem og tilbage langs retningsbevægelse?
- Deep-time Digital Earth-programmet:Datadrevet opdagelse i geovidenskab
- Ny teknik fremskynder måling af ultrahurtige pulser
- Japan betaler op til 320 millioner USD for amerikansk virksomheds chipproduktion
- Forskel mellem natriumatom og ion?
- Hvad gør os til mennesker? Studier af chimpanse og menneskeligt DNA kan fortælle


