Er NH3 polær kovalent eller ikke -polær kovalent?
* Elektronegativitet: Nitrogen (N) er mere elektronegativ end brint (H). Dette betyder, at nitrogen tiltrækker de delte elektroner i N-H-bindingerne stærkere.
* molekylær geometri: Ammoniakmolekylet har en trigonal pyramidal form. Det ensomme par elektroner på nitrogenatomet skaber en ujævn fordeling af elektrondensitet, hvilket gør den ene side af molekylet lidt negativ og den anden side lidt positiv.
* dipolmoment: Den ulige deling af elektroner og den molekylære form resulterer i et netto dipolmoment, hvilket indikerer en permanent adskillelse af ladning inden for molekylet.
Derfor gør de polære kovalente bindinger og den samlede molekylære form NH₃ til et polært molekyle.
 Varme artikler
Varme artikler
-
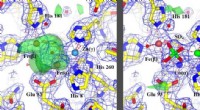 Ny røntgenmetode har dybtgående konsekvenser for udviklingen af livreddende lægemidlerDen nye metode, korrigere de forkert identificerede metaller, tilladt genfortolkning af uidentificerede funktioner, fremhævet med grønt, (billede til venstre) for at identificere, hvordan proteinet vi
Ny røntgenmetode har dybtgående konsekvenser for udviklingen af livreddende lægemidlerDen nye metode, korrigere de forkert identificerede metaller, tilladt genfortolkning af uidentificerede funktioner, fremhævet med grønt, (billede til venstre) for at identificere, hvordan proteinet vi -
 Påvisning af fortyndhed:Nye eksperimentelle og teoretiske tilgange dykker ned i puljen af membran…Ingeniører ved Washington University i St. Louis og Princeton University udviklede en ny måde at dykke ned i cellens mindste og vigtigste komponenter. Hvad de fandt inde i membranløse organeller overr
Påvisning af fortyndhed:Nye eksperimentelle og teoretiske tilgange dykker ned i puljen af membran…Ingeniører ved Washington University i St. Louis og Princeton University udviklede en ny måde at dykke ned i cellens mindste og vigtigste komponenter. Hvad de fandt inde i membranløse organeller overr -
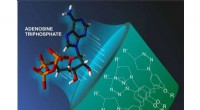 Fælder for energikildemolekyler i cellerKredit:Natalia Deryugina Et team af forskere, inklusive en RUDN-kemiker, har syntetiseret nye molekyler, der tilhører klassen af calixarener, skållignende hule strukturer. Disse stoffer ser ud t
Fælder for energikildemolekyler i cellerKredit:Natalia Deryugina Et team af forskere, inklusive en RUDN-kemiker, har syntetiseret nye molekyler, der tilhører klassen af calixarener, skållignende hule strukturer. Disse stoffer ser ud t -
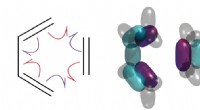 Teoretikere beviser endelig, at krøllede pile fortæller sandheden om kemiske reaktionerDiels-Alder-reaktionen er vigtig i syntesen af alle slags lægemidler, herunder D-vitamin. Men hvordan virker det? UNSW-forskere viser, at det involverer spaltning af elektronpar. Kredit:T. Schmidt
Teoretikere beviser endelig, at krøllede pile fortæller sandheden om kemiske reaktionerDiels-Alder-reaktionen er vigtig i syntesen af alle slags lægemidler, herunder D-vitamin. Men hvordan virker det? UNSW-forskere viser, at det involverer spaltning af elektronpar. Kredit:T. Schmidt
- Forskere opdager klynger af galakser i det tidlige univers
- Hvilken funktion af svingende bevægelse i uret?
- Mangel på vand udelukker liv på Venus:undersøgelse
- Google lancerede rettelse til Nest cam-look-through
- Menisk-assisteret teknik producerer højeffektiv perovskite PV-film
- Feminisering af vilde ørreder i Danmark viste sig at vende


