28,0 g prøve af nitrogengas kombineres med 6,0 brint til for Amonia Hvad er massen Amonia?
1. Skriv den afbalancerede kemiske ligning:
N₂ + 3H₂ → 2NH₃
Dette fortæller os, at 1 mol nitrogengas (N₂) reagerer med 3 mol brintgas (H₂) for at producere 2 mol ammoniak (NH₃).
2. Beregn molen for hver reaktant:
* nitrogen (n₂):
* Molmasse på N₂ =28,0 g/mol
* Mol n₂ =(28,0 g) / (28,0 g / mol) =1,0 mol
* brint (H₂):
* Molmasse af H₂ =2,0 g/mol
* Mol H₂ =(6,0 g) / (2,0 g / mol) =3,0 mol
3. Bestem den begrænsende reaktant:
Den afbalancerede ligning viser, at 1 mol N₂ reagerer med 3 mol H₂. Vi har nøjagtigt den rigtige mængde af hver reaktant, så ingen af dem er begrænsende.
4. Beregn molen af produceret ammoniak:
Fra den afbalancerede ligning producerer 1 mol N₂ 2 mol NH₃. Da vi har 1 mol N₂, producerer vi 2 mol NH₃.
5. Beregn massen af produceret ammoniak:
* Molmasse af NH₃ =17,0 g/mol
* Massen af NH₃ =(2,0 mol) * (17,0 g/mol) =34,0 g
Derfor er massen af produceret ammoniak 34,0 g.
Sidste artikelHvor mange atomer er der i 32 g svovl?
Næste artikelEr NH3 polær kovalent eller ikke -polær kovalent?
 Varme artikler
Varme artikler
-
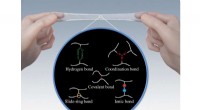 Elastomerer udvikler stærkere bindingsbindingerForskellige former for bindinger kan forbinde elastomerkæder sammen, ændre hvordan materialet opfører sig. Kredit:Yukikazu Takeoka Elastomerer er de bløde, elastiske materialer, som geler og gummi
Elastomerer udvikler stærkere bindingsbindingerForskellige former for bindinger kan forbinde elastomerkæder sammen, ændre hvordan materialet opfører sig. Kredit:Yukikazu Takeoka Elastomerer er de bløde, elastiske materialer, som geler og gummi -
 Syntetisk gelatine-lignende materiale efterligner jomfruhummers stræk og styrkeEn stålpartikel er vist, der trænger gennem den nanofibrøse hydrogel og forlader den med en reduceret hastighed. Forskellen i hastighed før og efter gav forskerne en direkte måling af materialets slag
Syntetisk gelatine-lignende materiale efterligner jomfruhummers stræk og styrkeEn stålpartikel er vist, der trænger gennem den nanofibrøse hydrogel og forlader den med en reduceret hastighed. Forskellen i hastighed før og efter gav forskerne en direkte måling af materialets slag -
 Open source-software behandler hurtigt spektrale data, identificerer og kvantificerer lipidarter nø…LIQUID-grænsefladen. Kredit:Pacific Northwest National Laboratory Lipider spiller en nøglerolle i mange stofskiftesygdomme, herunder hypertension, diabetes, og slagtilfælde. Så det er vigtigt at h
Open source-software behandler hurtigt spektrale data, identificerer og kvantificerer lipidarter nø…LIQUID-grænsefladen. Kredit:Pacific Northwest National Laboratory Lipider spiller en nøglerolle i mange stofskiftesygdomme, herunder hypertension, diabetes, og slagtilfælde. Så det er vigtigt at h -
 Forskere kan forudsige og designe enkeltatomkatalysatorer til vigtige kemiske reaktionerKredit:CC0 Public Domain Forskere ved Tufts University, University College London (UCL), Cambridge University og University of California i Santa Barbara har vist, at en katalysator faktisk kan væ
Forskere kan forudsige og designe enkeltatomkatalysatorer til vigtige kemiske reaktionerKredit:CC0 Public Domain Forskere ved Tufts University, University College London (UCL), Cambridge University og University of California i Santa Barbara har vist, at en katalysator faktisk kan væ
- NASA finder de stærkeste storme i svækkelsen af den tropiske cyklon Sanba
- Hvornår ligger omdømmet?
- Den vedvarende fare efter landskabsbrande
- Mikroorganismernes rolle i industriel guldforarbejdning
- Skovgenopretningstiltag skal prioritere mangfoldighed frem for skala for billigere, langsigtet succe…
- Hvad er metallisk malm og ikke -malm?


