Hvordan bliver et iltatom oxidion?
1. Det grundlæggende
* iltatom: Et neutralt iltatom har 8 protoner (positivt ladet) og 8 elektroner (negativt ladet). Dette gør det elektrisk neutralt.
* Oxidion: En oxidion (O²⁻) har fået to ekstra elektroner. Den har nu 8 protoner og 10 elektroner, hvilket giver det en nettoafgift på -2.
2. Processen
Oxygenatomer er meget elektronegative, hvilket betyder, at de har en stærk attraktion for elektroner. Dette betyder, at de har en tendens til at få elektroner for at opnå en stabil elektronkonfiguration.
* At vinde elektroner: Oxygenatomer får typisk to elektroner for at opnå en fuld ydre skal af 8 elektroner. Denne stabile konfiguration er som den ædle gas neon.
* bliver en ion: Når et iltatom får to elektroner, bliver det negativt ladet og kaldes nu en oxidion (O²⁻).
3. Eksempler
Oxidioner er almindelige i mange forbindelser:
* Oxider: Metaloxider som magnesiumoxid (MGO) dannes ved reaktion af et metal med ilt. Oxygenatomerne får elektroner fra metalatomerne og danner oxidioner.
* hydroxider: Hydroxidioner (OH⁻) indeholder en oxidion bundet til et hydrogenatom. De findes i baser som natriumhydroxid (NaOH).
Sammenfattende bliver et iltatom en oxidion ved at få to elektroner for at opnå en stabil elektronkonfiguration, hvilket resulterer i en netto negativ ladning på -2.
 Varme artikler
Varme artikler
-
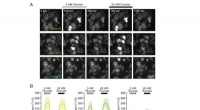 Grønne fluorescerende proteinbaserede glukoseindikatorer til overvågning af glukosemetabolisme i r…A:Billeder af HeLa -celler, der udtrykker Green Glifon50, Grøn Glifon600 og Grøn Glifon4000. Skalaen repræsenterer 20 μm. B:Ændringer i fluorescensintensitet (FI) i HeLa -celler, der udtrykker de tre
Grønne fluorescerende proteinbaserede glukoseindikatorer til overvågning af glukosemetabolisme i r…A:Billeder af HeLa -celler, der udtrykker Green Glifon50, Grøn Glifon600 og Grøn Glifon4000. Skalaen repræsenterer 20 μm. B:Ændringer i fluorescensintensitet (FI) i HeLa -celler, der udtrykker de tre -
 Ny måde at danne bioaktiv edderkoppesilke til medicinsk brugFor at skabe nanotråde placerede forskerne en dråbe på overfladen, og trak derefter dråben sideværts, efterlader tråde af materialet, der spænder over søjlerne. Kredit:KTH Kgl. Teknologisk Institut
Ny måde at danne bioaktiv edderkoppesilke til medicinsk brugFor at skabe nanotråde placerede forskerne en dråbe på overfladen, og trak derefter dråben sideværts, efterlader tråde af materialet, der spænder over søjlerne. Kredit:KTH Kgl. Teknologisk Institut -
 En ud af fem materialekemipapirer kan være forkerte, undersøgelse tyder påEn ny undersøgelse, der sammenlignede resultaterne rapporteret i tusindvis af artikler offentliggjort om egenskaberne af metal organiske rammematerialer (MOF) - som er fremtrædende kandidater til kuld
En ud af fem materialekemipapirer kan være forkerte, undersøgelse tyder påEn ny undersøgelse, der sammenlignede resultaterne rapporteret i tusindvis af artikler offentliggjort om egenskaberne af metal organiske rammematerialer (MOF) - som er fremtrædende kandidater til kuld -
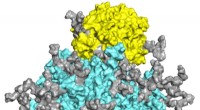 Ofte overset, molekyler kaldet glykaner regulerer COVID-19-spidsproteinfunktionenEn molekylær model viser det stærkt glykosylerede SARS-CoV-2-spidsprotein (cyan, med glykaner i grå og andre farver) bundet til den cellulære ACE2-receptor (gul). En ny undersøgelse fremhæver den krit
Ofte overset, molekyler kaldet glykaner regulerer COVID-19-spidsproteinfunktionenEn molekylær model viser det stærkt glykosylerede SARS-CoV-2-spidsprotein (cyan, med glykaner i grå og andre farver) bundet til den cellulære ACE2-receptor (gul). En ny undersøgelse fremhæver den krit
- Hvilke strukturer bevæger sig fra hinanden under mitose og skaber spindel?
- Hvad sker der med bevægelse af partikler observeret i Brownsk bevægelse, hvis du afkølede objektg…
- Robotdommere kommer til baseball. Vil de overstrege?
- Er fremtiden for arbejde nødvendigvis glamourøs? Digitale nomader og van-liv
- Et stort vulkanudbrud rystede Deception Island 3, 980 år siden
- Hvordan kan lys dræbe vira?


