Hvad er forskellen mellem en formelenhed og molekylær formel?
Formelenhed:
* gælder for: Ioniske forbindelser (forbindelser dannet af den elektrostatiske tiltrækning mellem positivt og negativt ladede ioner).
* repræsenterer: Det enkleste forhold mellem hele nummeret mellem ioner i forbindelsen.
* Eksempel: NaCl (natriumchlorid) - Formelenheden indikerer en natriumion (Na+) for hvert enkelt chloridion (Cl-).
* Bemærk: Formelenheder repræsenterer ikke faktiske molekyler, da der findes ioniske forbindelser som en gitterstruktur af ioner.
molekylær formel:
* gælder for: Kovalente forbindelser (forbindelser dannet ved deling af elektroner mellem atomer).
* repræsenterer: Det faktiske antal atomer for hvert element, der er til stede i et molekyle.
* Eksempel: H₂O (vand) - Den molekylære formel viser, at hvert vandmolekyle indeholder to hydrogenatomer (H) og et iltatom (O).
* Bemærk: Molekylære formler repræsenterer faktiske molekyler, som er diskrete enheder med en defineret struktur.
Kortfattet:
* Formelenheder bruges til ioniske forbindelser og repræsenterer det enkleste forhold mellem ioner.
* molekylære formler bruges til kovalente forbindelser og repræsenterer det faktiske antal atomer i et molekyle.
Her er en nyttig analogi:
Forestil dig, at du har en pose kugler.
* Formelenhed: Forholdet mellem rød og blå kugler i posen.
* molekylær formel: En enkelt marmor med specifikke farver og arrangement.
Sidste artikelHvilken gas fremstilles, når kalium reagerer med vand?
Næste artikelHvad er en vigtig forløber for sur regn?
 Varme artikler
Varme artikler
-
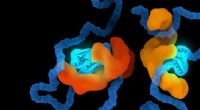 At forme proteiner for at forstå chaperone-relaterede sygdommeKredit:Leiden Universitet Chaperones er et sæt proteiner, der er specialiseret til at hjælpe proteiner i den menneskelige krop. De hjælper proteiner med at folde sig til den rigtige form og beskyt
At forme proteiner for at forstå chaperone-relaterede sygdommeKredit:Leiden Universitet Chaperones er et sæt proteiner, der er specialiseret til at hjælpe proteiner i den menneskelige krop. De hjælper proteiner med at folde sig til den rigtige form og beskyt -
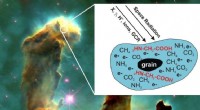 Hvordan livets byggesten kan dannes i rummetElektroner med lav energi skabt i stof af rumstråling (f.eks. galaktiske kosmiske stråler, GCR, etc.), kan inducere dannelse af glycin (2HN-CH2-COOH) i astrofysiske molekylære iser; her, iskolde korn
Hvordan livets byggesten kan dannes i rummetElektroner med lav energi skabt i stof af rumstråling (f.eks. galaktiske kosmiske stråler, GCR, etc.), kan inducere dannelse af glycin (2HN-CH2-COOH) i astrofysiske molekylære iser; her, iskolde korn -
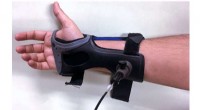 Forskere viser effektiviteten af en ny ikke -invasiv blodglukosetestRamanspektroskopi blodglukosemonitor. Kredit:Massachusetts Institute of Technology For dem, der lever med diabetes, nøjagtig overvågning af blodglukose er nødvendig for at forhindre diabetesrelate
Forskere viser effektiviteten af en ny ikke -invasiv blodglukosetestRamanspektroskopi blodglukosemonitor. Kredit:Massachusetts Institute of Technology For dem, der lever med diabetes, nøjagtig overvågning af blodglukose er nødvendig for at forhindre diabetesrelate -
 Video:Du bruger desinfektionsmidler forkert. Her er hvad du faktisk skal gøreKredit:The American Chemical Society Jo da, du har et produkt, der siger dræber bakterier under din vask, men vil det virkelig ødelægge den nye coronavirus på overflader? Det viser sig, at hvis d
Video:Du bruger desinfektionsmidler forkert. Her er hvad du faktisk skal gøreKredit:The American Chemical Society Jo da, du har et produkt, der siger dræber bakterier under din vask, men vil det virkelig ødelægge den nye coronavirus på overflader? Det viser sig, at hvis d


