At forme proteiner for at forstå chaperone-relaterede sygdomme
Kredit:Leiden Universitet
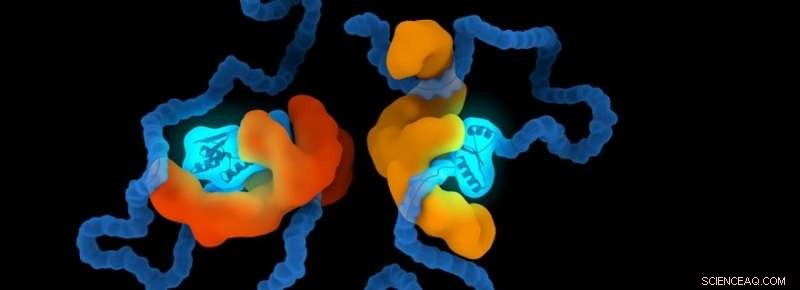
Chaperones er et sæt proteiner, der er specialiseret til at hjælpe proteiner i den menneskelige krop. De hjælper proteiner med at folde sig til den rigtige form og beskytter dem mod at tilpasse sig forkerte former. Forskergruppen af Alireza Mashaghi, adjunkt og hovedefterforsker ved LACDR, undersøger disse strukturer. Vahid Satarifard, kandidatstuderende i forskningsgruppen:"Mere end halvtreds sygdomme er blevet identificeret som værende forbundet med proteinfejlfoldning. Mange af dem er meget ødelæggende og i stigende grad udbredt." Ved proteopatiske sygdomme, proteiner kan foldes på den forkerte måde, bliver strukturelt unormalt. Dette får dem til at blive giftige eller miste deres normale funktion.
Det er ikke godt forstået, hvordan chaperoner hjælper andre molekyler. Det er blevet foreslået, at chaperoner binder til proteiner, og dette styrer deres foldning. Mashaghi:"Chaperoner er kendt for at pålægge deres klientproteiner en begrænsning, men hvorvidt disse begrænsninger har betydning for proteinfoldning er et åbent spørgsmål. Nogle chaperoner tager kontakt med deres klientpolypeptider og begrænser dem internt; andre krammer deres klienter og begrænser dem eksternt. Vi viste, at disse indeslutninger faktisk kan påvirke foldningsprocessen. Visse former er mindre optaget, mens andre dannes med en øget sandsynlighed. Vi identificerede regler, der styrer denne proces." Disse regler viser sandsynligheden for, at et protein antager en bestemt form under en given begrænsning.
Beskæftiger sig med former
Mashaghi:"Vi spurgte, om vi kan definere topologien for et lineært molekyle såsom et protein eller DNA. Topologi omhandler former. En kerneidé på dette felt er, at hvis man tager et objekt og deformerer det kontinuerligt, topologiske træk ændres ikke, men diskontinuerlig deformation, såsom at bryde et objekt, ændrer dets topologi."
Mashaghi har en baggrund i biofysik. "At trække i to ender af forskellige proteiner og DNA-stykker er meget som at trække i et reb. For reb, knudeteori fungerer som en standardramme til at definere former. Hvad vi og andre forskere indså var, at mere end 97 procent af vores proteiner ikke danner en knude, når du trækker i dem og dermed falder i én formklasse, nemlig 'uknotten'. Vi spurgte os selv, om vi kunne definere topologien for disse 97 procent af proteinerne og derfor være i stand til at kategorisere dem baseret på deres former."
Først, forskerholdet simulerede en polymerkæde indespærret inde i en kugle. Derefter, de undersøgte, hvordan denne fastholdelse kan påvirke strukturen. Satarifard:"I denne undersøgelse brugte vi veletablerede polymermodeller med en ny ramme, med fokus på form frem for størrelse og afstande. Denne ramme kan give et nyt syn på struktur baseret på kontakt arrangement. Vi antager, at der i biopolymerer findes lignende kredsløb, hvilket ville være ret fleksibelt under nogle forhold."
Simulering af et biomolekyle
Forskerholdet sammenlignede også formerne på en ubegrænset kæde med, når den er begrænset eksternt eller internt af et andet molekyle. Maziar Heidari, en af kandidatstuderende, udtaler:"Dette er vigtigt i biologien, fordi funktionaliteten af et biomolekyle i høj grad bestemmes af dets form. F.eks. måden, hvorpå et protein foldes og skjuler dets bindingssteder, kan påvirke dets funktionaliteter og interaktioner med de andre proteiner."
Forskerholdet observerede, at den interne form og foldeorganisation ændrer sig væsentligt, efterhånden som kæden gennemgår forskellige niveauer af indespærring. Heidari:"Dette er interessant, fordi dette kaster lys over funktionaliteten og dynamikken af de mulige mekanismer og veje, hvorigennem et eksternt molekyle, såsom en chaperone, folder og begrænser sine klientmolekyler. Derudover, vores resultater er ikke begrænset til undersøgelsen af de eksisterende biologiske molekyler. Vores resultater kan inspirere andre videnskabsmænd til at designe et kunstigt molekyle eller et lægemiddel, der er rettet mod protein- eller genomfoldningsprocesser."
Sidste artikelBygger krystaller på en meget varm overflade
Næste artikelUdvikling af oral medicin, der virker mere effektivt
 Varme artikler
Varme artikler
-
 Vand spiller en afgørende rolle i mekanismen for Henry-reaktionen katalyseret af nye kobberkompleks…Kredit:RUDN Universitet En kemiker fra RUDN University reviderede mekanismen for Henry-reaktionen katalyseret af kobber(II)-komplekser. Dermed, ved hjælp af nye kobber(II)-komplekser opnået i samm
Vand spiller en afgørende rolle i mekanismen for Henry-reaktionen katalyseret af nye kobberkompleks…Kredit:RUDN Universitet En kemiker fra RUDN University reviderede mekanismen for Henry-reaktionen katalyseret af kobber(II)-komplekser. Dermed, ved hjælp af nye kobber(II)-komplekser opnået i samm -
 Guldbindingsdannelse spores i realtid ved hjælp af ny molekylær spektroskopi-teknikFigur 1:Et formskiftende molekyle snapper fra en bøjet (øverst til højre) til en lige struktur (nederst til højre), når det rammes af en ultraviolet laserimpuls (lilla krumspring øverst i midten). To
Guldbindingsdannelse spores i realtid ved hjælp af ny molekylær spektroskopi-teknikFigur 1:Et formskiftende molekyle snapper fra en bøjet (øverst til højre) til en lige struktur (nederst til højre), når det rammes af en ultraviolet laserimpuls (lilla krumspring øverst i midten). To -
 Forskere løser det 100-årige metallurgipuslespilFor at forstå præcis, hvordan metaller reagerer på højhastighedskomprimering i molekylære dynamiksimuleringer, LLNL -forskere bruger nye metoder til silikomikroskopi til at afsløre defekter i krystalg
Forskere løser det 100-årige metallurgipuslespilFor at forstå præcis, hvordan metaller reagerer på højhastighedskomprimering i molekylære dynamiksimuleringer, LLNL -forskere bruger nye metoder til silikomikroskopi til at afsløre defekter i krystalg -
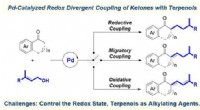 Ny strategi udviklet til redox divergerende kobling af ketoner med terpenerPd-katalyseret redox divergerende kobling af ketoner med terpenoler. Kredit:ZHAO Chaoyang Hydrogenering og dehydrogenering er to vigtige kunstige metoder til at ændre redoxtilstanden af forbinde
Ny strategi udviklet til redox divergerende kobling af ketoner med terpenerPd-katalyseret redox divergerende kobling af ketoner med terpenoler. Kredit:ZHAO Chaoyang Hydrogenering og dehydrogenering er to vigtige kunstige metoder til at ændre redoxtilstanden af forbinde
- Glykaner som biomarkører for kræft?
- Sådan bruges en TI-83 til at konvertere til metrisk
- Undersøgelse kaster mere lys over arten af den forbigående røntgenpulsar MAXI J1409-619
- Fuldfarvede LED'er skæres ned i størrelse
- Fysikere opdager måde at konstruere nye egenskaber på ultratynde nanomaterialer
- Skal vi bekymre os om, at halvdelen af amerikanerne stoler på, at deres mavefornemmelse fortælle…


