Hvorfor er mængderne af produkter dannet i en reaktion, der kun bestemmes ved at begrænse reaktanten?
1. Begrænsende reaktant:
* Den begrænsende reaktant er reaktanten, der er fuldstændigt konsumeret i en kemisk reaktion.
* Det sætter en øvre grænse for, hvor meget produkt der kan dannes.
2. Overskydende reaktant:
* Den overskydende reaktant er den reaktant, der ikke forbruges fuldstændigt i en kemisk reaktion.
* Det har en vis mængde tilbage, når reaktionen er afsluttet.
3. Reaktionens støkiometri:
* Den afbalancerede kemiske ligning for reaktionen tilvejebringer de støkiometriske forhold mellem reaktanter og produkter. Dette betyder, at det fortæller os de nøjagtige mængder af hvert stof, der er involveret i reaktionen.
Sådan fungerer det:
1. Forestil dig en opskrift: Du har en opskrift på cookies, der kræver 2 kopper mel og 1 kop sukker. Hvis du kun har 1 kop mel, kan du kun lave halvdelen af mængden af cookies, selvom du har masser af sukker. Melet er den begrænsende reaktant.
2. Den begrænsende reaktant løber først ud: I en kemisk reaktion bliver den begrænsende reaktant brugt helt op før de andre reaktanter. Når den er væk, stopper reaktionen.
3. Der kan ikke dannes mere produkt: Da reaktionen stopper, når den begrænsende reaktant er brugt op, kan der ikke dannes mere produkt, selvom der er overskydende af andre reaktanter.
Eksempel:
Lad os sige, at du har 10 gram natrium (NA) og 10 gram chlor (CL), der reagerer på at danne natriumchlorid (NaCl):
`` `
2 Na + Cl2 → 2 NaCl
`` `
* Trin 1:Beregn mol: Beregn molen for hver reaktant ved hjælp af deres molære masser.
* Trin 2:Bestem den begrænsende reaktant: Sammenlign molforholdene for reaktanterne baseret på støkiometrien af reaktionen. Reaktanten med det nedre molforhold (i forhold til koefficienterne i den afbalancerede ligning) er den begrænsende reaktant.
* Trin 3:Beregn mængden af produkt: Mængden af dannet produkt bestemmes af mængden af den begrænsende reaktant, der forbruges.
Kortfattet: Den begrænsende reaktant styrer mængden af produkt, der er dannet, fordi det er den første, der er fuldt konsumeret, og derved stopper reaktionen og forhindrer yderligere produktdannelse.
 Varme artikler
Varme artikler
-
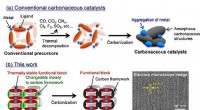 En ny synteserute for alternative katalysatorer af ædelmetallerSynteseskemaer af (a) konventionelle carbonholdige katalysatorer og (b) dette arbejde for ordnede carbonholdige rammer. Kredit:Hirotomo Nishihara Forskere har udviklet en ny synteserute for altern
En ny synteserute for alternative katalysatorer af ædelmetallerSynteseskemaer af (a) konventionelle carbonholdige katalysatorer og (b) dette arbejde for ordnede carbonholdige rammer. Kredit:Hirotomo Nishihara Forskere har udviklet en ny synteserute for altern -
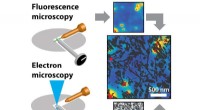 Forsker sporer præcist bevægelser af en enkelt katalysatorpartikelKredit:Utrecht University Faculty of Science Ved hjælp af fluorescensmikroskopi, Ph.D. Kandidat Frank Hendriks har undersøgt tilgængeligheden, struktur og reaktivitet af individuelle katalysatorpa
Forsker sporer præcist bevægelser af en enkelt katalysatorpartikelKredit:Utrecht University Faculty of Science Ved hjælp af fluorescensmikroskopi, Ph.D. Kandidat Frank Hendriks har undersøgt tilgængeligheden, struktur og reaktivitet af individuelle katalysatorpa -
 Plastik fra træ? Røntgenanalyse viser vej til ligninbaserede komponenter fremstillet efter målLignin er et lovende råmateriale (til venstre) til termoplastproduktion (til højre). Kredit:KTH Stockholm, Marcus Jawerth Biopolymeren lignin er et biprodukt fra papirfremstilling og et lovende rå
Plastik fra træ? Røntgenanalyse viser vej til ligninbaserede komponenter fremstillet efter målLignin er et lovende råmateriale (til venstre) til termoplastproduktion (til højre). Kredit:KTH Stockholm, Marcus Jawerth Biopolymeren lignin er et biprodukt fra papirfremstilling og et lovende rå -
 Nye bioinspirerede hydrogeler kan fungere som superlim i meget ioniske miljøer som havvandDen nyudviklede gel klæber til negativt ladede faste overflader under meget ioniske forhold, såsom i havvand. Kredit:Hailong Fan et al., Naturkommunikation, 12. november kl. 2019 Forskere har arbe
Nye bioinspirerede hydrogeler kan fungere som superlim i meget ioniske miljøer som havvandDen nyudviklede gel klæber til negativt ladede faste overflader under meget ioniske forhold, såsom i havvand. Kredit:Hailong Fan et al., Naturkommunikation, 12. november kl. 2019 Forskere har arbe
- Tager ansvaret for at finde den rigtige balance for avancerede optoelektroniske enheder
- Peruvianske stalagmitter et nyt grundlag for 'Besværlig sandhed'?
- Hvad bruges formaldehyd industrielt til at fremstille?
- Hvad er definitionen af restistance?
- Tilbyder proteiner det meste af energien til livsprocesser?
- Unikt materiale kunne låse op for ny funktionalitet i halvledere


