I den sammensatte natriumfluorid mister NAF thev -atomet en elektron- og fluorgevinster til dannelse af ioner, der har elektronerskonfigurationer, der ligner?
* natrium (NA): Natrium har et atomnummer på 11, hvilket betyder, at det har 11 elektroner. Dens elektronkonfiguration er 1S² 2s² 2p⁶ 3S¹. Når natrium mister en elektron, bliver det en positivt ladet ion (Na⁺) med elektronkonfigurationen 1S² 2s² 2p⁶ , som er det samme som den ædle gas neon (NE) .
* fluor (F): Fluor har et atomnummer på 9, hvilket betyder, at det har 9 elektroner. Dens elektronkonfiguration er 1S² 2s² 2p⁵. Når fluor vinder en elektron, bliver det en negativt ladet ion (F⁻) med elektronkonfigurationen 1S² 2s² 2p⁶ , som også er det samme som den ædle gas neon (NE) .
Kortfattet:
Ved at miste en elektron opnår natrium en stabil elektronkonfiguration som neon. Ved at få en elektron opnår fluor også en stabil elektronkonfiguration som neon. Denne tendens til at vinde eller miste elektroner for at opnå en stabil ædelgaskonfiguration er et centralt princip i ionisk binding.
 Varme artikler
Varme artikler
-
 Et nyt potentielt alternativ til myggebekæmpelse opdagetKredit:CC0 Public Domain Naturlige æteriske olier udvundet af skallen af en citrusfrugt kunne være et effektivt nyt miljøvenligt alternativ i myggekontrolprogrammer, rapporterer en ny undersøgel
Et nyt potentielt alternativ til myggebekæmpelse opdagetKredit:CC0 Public Domain Naturlige æteriske olier udvundet af skallen af en citrusfrugt kunne være et effektivt nyt miljøvenligt alternativ i myggekontrolprogrammer, rapporterer en ny undersøgel -
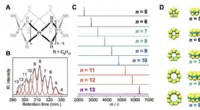 En forberedende reaktion ved hjælp af platinklynger med en encifret atomicitet realiseretFigur (A) viser kompleksernes kemiske struktur, (B) viser kromatogrammet for HPLC -adskillelsen med størrelsesekskluderingskolonner, (C) viser MALDI-TOF-massespektre for de isolerede platinkomplekser
En forberedende reaktion ved hjælp af platinklynger med en encifret atomicitet realiseretFigur (A) viser kompleksernes kemiske struktur, (B) viser kromatogrammet for HPLC -adskillelsen med størrelsesekskluderingskolonner, (C) viser MALDI-TOF-massespektre for de isolerede platinkomplekser -
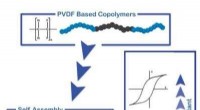 Ferroelektriske polymerer gjort mere alsidigeEn blokcopolymer af PVDF (sort) og en isolerende polymerkæde (blå) danner en blokcopolymer. Gennem faseadskillelse, blokkene samles i film. De dielektriske egenskaber kan indstilles ved at variere sam
Ferroelektriske polymerer gjort mere alsidigeEn blokcopolymer af PVDF (sort) og en isolerende polymerkæde (blå) danner en blokcopolymer. Gennem faseadskillelse, blokkene samles i film. De dielektriske egenskaber kan indstilles ved at variere sam -
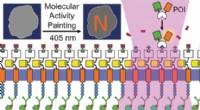 Molekylær aktivitet maleri til at kontrollere og overvåge switch-lignende, lyskontrollerede forsty…Kredit:Wiley Plasmamembranen tjener som et vigtigt knudepunkt for signalkaskader til styring af afgørende cellulære processer. Men det er et flydende medium, hvilket gør signaleringsprocesserne sv
Molekylær aktivitet maleri til at kontrollere og overvåge switch-lignende, lyskontrollerede forsty…Kredit:Wiley Plasmamembranen tjener som et vigtigt knudepunkt for signalkaskader til styring af afgørende cellulære processer. Men det er et flydende medium, hvilket gør signaleringsprocesserne sv


