Hvor mange mol brint kræves for at producere 18,00 ammoniak?
1. Skriv den afbalancerede kemiske ligning:
N₂ (G) + 3 H₂ (G) → 2 NH₃ (G)
Denne ligning fortæller os, at 1 mol nitrogengas reagerer med 3 mol brintgas til at producere 2 mol ammoniak.
2. Bestem molen af ammoniak:
Du får 18,00 gram ammoniak (NH₃). For at finde molerne skal du bruge den molære masse af ammoniak:
* Molmasse af NH₃ =14,01 g/mol (N) + 3 (1,01 g/mol) (H) =17,03 g/mol
Mol NH₃ =(18,00 g) / (17,03 g / mol) =1,057 mol NH₃
3. Brug molforholdet fra den afbalancerede ligning:
Den afbalancerede ligning viser, at 2 mol NH₃ produceres for hver 3. mol H₂. Opret en andel:
(3 mol H₂) / (2 mol nh₃) =(x mol h₂) / (1.057 mol nh₃)
4. Løs for x (mol H₂):
Kryds-multiply og løsning for x:
2x =3 * 1.057
2x =3.171
x =1,586 mol H₂
Derfor har du brug for 1,586 mol brintgas for at producere 18,00 gram ammoniak.
 Varme artikler
Varme artikler
-
 ARS bomuldsforskud hjælper med at starte sårforbindingTACgauze er en ny ikke -vævet bomuldsgas fra ARS og samarbejdspartnere, der hjælper med at standse blødninger og fremme sårheling. Kredit:H&H En ny, ikke -vævet bomuldsbind, der hurtigt standser b
ARS bomuldsforskud hjælper med at starte sårforbindingTACgauze er en ny ikke -vævet bomuldsgas fra ARS og samarbejdspartnere, der hjælper med at standse blødninger og fremme sårheling. Kredit:H&H En ny, ikke -vævet bomuldsbind, der hurtigt standser b -
 Fjerneksperimenter viser værdien af globale forbindelser under pandemienForskere fra University of Leeds sendte SSRL-specialiseret udstyr, som de brugte til at undersøge, hvordan vaskemidler krystalliserer. Det tætteste, de kom på at sætte fod i en hytte på SSRL, var fjer
Fjerneksperimenter viser værdien af globale forbindelser under pandemienForskere fra University of Leeds sendte SSRL-specialiseret udstyr, som de brugte til at undersøge, hvordan vaskemidler krystalliserer. Det tætteste, de kom på at sætte fod i en hytte på SSRL, var fjer -
 Ny klasse af solceller, brug af blyfri perovskitmaterialerBlyfri Perovskite flim (til venstre) og farvefølsomme organiske solceller (højre). Kredit:UNIST Blybaserede perovskiter er lovende materialer til billige og højeffektive solceller. Imidlertid, den
Ny klasse af solceller, brug af blyfri perovskitmaterialerBlyfri Perovskite flim (til venstre) og farvefølsomme organiske solceller (højre). Kredit:UNIST Blybaserede perovskiter er lovende materialer til billige og højeffektive solceller. Imidlertid, den -
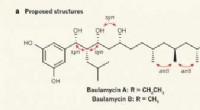 Kemikere udleder den korrekte struktur af A- og B-baulamycinerneTidligere foreslåede og faktiske molekylære strukturer af baulamycinerne. Kredit: Natur (2017). doi:10.1038/nature23265 (Phys.org) – Et team af kemikere ved University of Bristol har korrekt udle
Kemikere udleder den korrekte struktur af A- og B-baulamycinerneTidligere foreslåede og faktiske molekylære strukturer af baulamycinerne. Kredit: Natur (2017). doi:10.1038/nature23265 (Phys.org) – Et team af kemikere ved University of Bristol har korrekt udle
- Hvor mange gange roterer mmon på sin akse i en månecyklus?
- Høje ende af klimafølsomhed i nye klimamodeller anses for at være mindre plausible
- Hvad er en hård og rocklignende fossil?
- Bruger planteceller ligander og receptorer?
- Fra Jorden ser en satellit ud til at overhale en anden, jo hurtigere er?
- Er den underliggende klippe under Ocean Floor Silica?


