Hvor mange elektroner, der er til stede i en sulfation, hvordan er det til binding ion?
1. Forståelse af strukturen
* svovl (r): Svovl har 6 valenselektroner (elektroner i sin yderste skal).
* ilt (O): Hvert iltatom har 6 valenselektroner.
* opladning: Den 2-ladning angiver, at ion har vundet to ekstra elektroner.
2. Total valenselektroner
* Svovl:6 elektroner
* Oxygen (4 atomer):6 elektroner/atom * 4 atomer =24 elektroner
* Ladning:+2 elektroner (opnåede elektroner)
* i alt: 6 + 24 + 2 =32 elektroner
3. Limning af elektroner
* kovalente obligationer: Svovl danner dobbeltbindinger med hvert af de fire iltatomer. Hver dobbeltbinding involverer deling af 4 elektroner (2 fra hvert atom).
* Samlede limningselektroner: 4 dobbeltbindinger * 4 elektroner/binding =16 elektroner
Derfor er der 16 elektroner involveret i binding inden for en sulfation.
Vigtig note: De resterende 16 elektroner (32 i alt - 16 binding) er ikke -bindende elektroner, der bor som ensomme par på iltatomerne.
 Varme artikler
Varme artikler
-
 Navngiv det skotske:Kolorimetrisk genkendelse af aldehyder og ketonerKredit:Wiley Vodka smager anderledes end brandy, og kendere kan skelne mellem forskellige whiskymærker. Smagen af spiritus er et resultat af en kompleks buket af flygtige forbindelser. Nye kolor
Navngiv det skotske:Kolorimetrisk genkendelse af aldehyder og ketonerKredit:Wiley Vodka smager anderledes end brandy, og kendere kan skelne mellem forskellige whiskymærker. Smagen af spiritus er et resultat af en kompleks buket af flygtige forbindelser. Nye kolor -
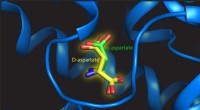 Montering af en højre hånd i en venstrehåndsvanteDenne illustration viser L- og D-aspartat på bindingsstedet for transportproteinet. Kredit:Valentina Arkhipova, University of Groningen Mange biomolekyler findes i to versioner, der er hinandens s
Montering af en højre hånd i en venstrehåndsvanteDenne illustration viser L- og D-aspartat på bindingsstedet for transportproteinet. Kredit:Valentina Arkhipova, University of Groningen Mange biomolekyler findes i to versioner, der er hinandens s -
 Voksende krystaller til at generere tilfældige talKredit: Stof (2020). DOI:10.1016/j.matt.2020.01.024 Et team ved University of Glasgow har udviklet en ny måde at generere tilfældige tal ved at bruge tilfældigheden i krystalvækst. I deres papir
Voksende krystaller til at generere tilfældige talKredit: Stof (2020). DOI:10.1016/j.matt.2020.01.024 Et team ved University of Glasgow har udviklet en ny måde at generere tilfældige tal ved at bruge tilfældigheden i krystalvækst. I deres papir -
 Lab afslører ny virkningsmekanisme mod SARS-CoV-2 af antiviralt lægemiddel remdesivir(Top) Den virale polymerase (blå oval) inkorporerer remdesivir (rød) i RNA-primerstrengen (grønne bobler) modsat uridin i skabelonen (gule/klare bobler). Et sammenstød mellem remdesivir og aminosyren
Lab afslører ny virkningsmekanisme mod SARS-CoV-2 af antiviralt lægemiddel remdesivir(Top) Den virale polymerase (blå oval) inkorporerer remdesivir (rød) i RNA-primerstrengen (grønne bobler) modsat uridin i skabelonen (gule/klare bobler). Et sammenstød mellem remdesivir og aminosyren
- Hvilken malmrock indeholder aluminium?
- Fuselage af ny Boeing 777X bristede i tryktest
- Hvad beskriver elementer, der er fremstillet i partikelacceleratorer og ikke fundet natur?
- Hvad er en Hi-Shear Fastgøring?
- Fremskridt inden for taxolbiosyntese kan føre til storstilet produktion af anticancerlægemiddel
- Petrichor:Hvad forårsager den jordagtige lugt efter regn?


