Hvorfor er strukturerne af H2S og H2O så ens?
* Elektronegativitet: Oxygen er meget mere elektronegativ end svovl. Dette betyder, at ilt tiltrækker elektroner stærkere i en binding. I H₂O trækker iltatomet de delte elektroner tættere, hvilket skaber en delvis negativ ladning på ilt og delvis positive ladninger på hydrogenerne. Dette skaber et stærkt dipolmoment i vandmolekylet, hvilket gør det meget polært.
* binding: H-O-bindingen i vand er signifikant stærkere end H-S-bindingen i hydrogensulfid. Dette skyldes, at iltatomet er mindre og kan danne stærkere bindinger på grund af dets højere elektronegativitet. Den svagere H-S-binding i hydrogensulfid bidrager også til dets lavere kogepunkt.
* Hydrogenbinding: Vands stærke polaritet og hydrogenbindingsfunktioner (på grund af den stærke H-O-binding og delvise positive ladninger på brint) gør det til et meget polært molekyle. Hydrogensulfid, der mangler så stærke bindinger og polaritet, danner ikke hydrogenbindinger i samme grad.
Her er et resumé:
* form: Både H₂s og H₂O er bøjet på grund af de ensomme par på det centrale atom.
* binding: H-O-bindingen er stærkere og mere polær end H-S-bindingen.
* Polaritet: H₂O er et meget polært molekyle på grund af dets stærke dipolmoment, mens H₂S er mindre polær.
* Hydrogenbinding: Vand danner stærke hydrogenbindinger, hvilket påvirker dets egenskaber væsentligt, mens hydrogensulfid ikke gør det.
På trods af en lignende form fører forskellene i elektronegativitet, bindingsstyrke og hydrogenbinding til meget forskellige egenskaber for vand og hydrogensulfid.
Sidste artikelHvad er den kemiske formel for cadmium II perchlorat?
Næste artikelHvad hedder Compound Naaloh4?
 Varme artikler
Varme artikler
-
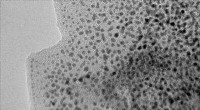 Forskere udvikler nyt materiale til længerevarende brændselscellerTransmissionselektronmikrofotografi af grafen dekoreret med platinnanopartikler. De mørke pletter er platinnanopartiklerne, og det grå ark, de ligger på, er grafenunderstøtningsmaterialet. Kredit:Patr
Forskere udvikler nyt materiale til længerevarende brændselscellerTransmissionselektronmikrofotografi af grafen dekoreret med platinnanopartikler. De mørke pletter er platinnanopartiklerne, og det grå ark, de ligger på, er grafenunderstøtningsmaterialet. Kredit:Patr -
 Undersøgelse afslører dannelsesmekanismen for den første carbon-carbon-binding i MTO-processenAfsløring af hele de første C-C-bindingsdannelsesprocesser i MTO-reaktion:baseret på in situ NMR spektroskopiske beviser og avanceret ab initio molekylær dynamik (AIMD) teoretisk beregningsmetode. Kre
Undersøgelse afslører dannelsesmekanismen for den første carbon-carbon-binding i MTO-processenAfsløring af hele de første C-C-bindingsdannelsesprocesser i MTO-reaktion:baseret på in situ NMR spektroskopiske beviser og avanceret ab initio molekylær dynamik (AIMD) teoretisk beregningsmetode. Kre -
 Gør dig klar til sommersolen med grønne solcremerKredit:American Chemical Society Selvom det har været en hård vinter for mange mennesker i USA, sommeren kommer. Og det betyder baggårdsgrill, sjov på stranden og selvfølgelig, sladder på solcreme
Gør dig klar til sommersolen med grønne solcremerKredit:American Chemical Society Selvom det har været en hård vinter for mange mennesker i USA, sommeren kommer. Og det betyder baggårdsgrill, sjov på stranden og selvfølgelig, sladder på solcreme -
 Elektronisk entropi forbedrer vandspaltningKredit:George Hodan/public domain Forskere har længe vidst, at cerium er det bedste element at bruge, når man spalter vand til brint og ilt - en nøgleteknik til at skabe brintgas til brændstof. Me
Elektronisk entropi forbedrer vandspaltningKredit:George Hodan/public domain Forskere har længe vidst, at cerium er det bedste element at bruge, når man spalter vand til brint og ilt - en nøgleteknik til at skabe brintgas til brændstof. Me
- Hvordan er Sun Nuclear Energy?
- Forskere studerer unikke undersøiske stalaktitter
- Hvad er et eksempel på naturfremstillet plasma?
- Hvilken forbedring af fysik har bidraget til dig og Filipinos Society?
- Hvorfor miner du dig for kalksten?
- Hvor varmt er for varmt? Sådan fortæller du, om din hund lider under sommervarmen


