Ioniske bindinger mellem kalium og jod?
1. Forstå spillerne
* kalium (k): Kalium er et metal placeret i gruppe 1 i den periodiske tabel. Det har en valenselektron (elektron i dets yderste skal). Metaller har en tendens til at miste elektroner for at opnå en stabil elektronkonfiguration.
* jod (i): Jod er en ikke -metal placeret i gruppe 17 i den periodiske tabel. Det har syv valenselektroner. Ikke -metaller har en tendens til at få elektroner for at opnå en stabil elektronkonfiguration.
2. Dannelsen af obligationen
* Elektronoverførsel: Kalium mister let sin ene valenselektron for at blive en positivt ladet ion (K+). Jod får let en elektron for at blive en negativt ladet ion (I-).
* Elektrostatisk attraktion: De modsatte ladede ioner (K+ og I-) tiltrækker hinanden stærkt på grund af elektrostatiske kræfter. Denne stærke attraktion danner den ioniske binding.
3. Den resulterende forbindelse
* kaliumiodid (KI): Den resulterende forbindelse er kaliumiodid (KI). Det er et hvidt, krystallinsk fast stof, der ofte bruges i medicin og som et kosttilskud.
Nøglepunkter
* ioniske bindinger dannes mellem metaller og ikke -metaller.
* Overførslen af elektroner skaber ioner med modsatte afgifter.
* Den stærke elektrostatiske tiltrækning mellem ionerne holder forbindelsen sammen.
visuel repræsentation:
Du kan tænke på obligationen som en simpel overførsel:
[K] + [i] -> [k +] + [i-] -> ki
Sammenfattende er den ioniske binding mellem kalium og jod et resultat af overførslen af et elektron fra kalium til jod, hvilket skaber modsat ladede ioner, der tiltrækker hinanden stærkt.
Sidste artikelHvad er formlen for kobberhydroxid?
Næste artikelReaktion af natriumhydroxidcarbonat og calciumcarbonat?
 Varme artikler
Varme artikler
-
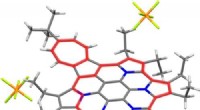 Dobbelt aromatiske ringe stabiliserer multikationerPyrrol- og azulenfusioneret azacoronen-dikering med 22π 6π aromatiske ringe. Kredit:American Chemical Society Et redoxaktivt polycyklisk aromatisk kulbrinte (PAHer) sammensat af azulen og pyrroler
Dobbelt aromatiske ringe stabiliserer multikationerPyrrol- og azulenfusioneret azacoronen-dikering med 22π 6π aromatiske ringe. Kredit:American Chemical Society Et redoxaktivt polycyklisk aromatisk kulbrinte (PAHer) sammensat af azulen og pyrroler -
 Nanocontainere til målrettet lægemiddelleveringKredit:RUDN Universitet RUDN University bioingeniører har skabt magnetiske nanocontainere til smart levering af lægemidler til de ønskede organer eller væv, hvilket mindsker risikoen for bivirknin
Nanocontainere til målrettet lægemiddelleveringKredit:RUDN Universitet RUDN University bioingeniører har skabt magnetiske nanocontainere til smart levering af lægemidler til de ønskede organer eller væv, hvilket mindsker risikoen for bivirknin -
 Energihøstende plastik består syretestenDiego Rosas-Villalva forklarede, at holdet var overrasket over, at en så ekstremt tynd polymer var så effektiv til at forbedre enhedens levetid. Kredit:KAUST En polymer, der tidligere blev brugt t
Energihøstende plastik består syretestenDiego Rosas-Villalva forklarede, at holdet var overrasket over, at en så ekstremt tynd polymer var så effektiv til at forbedre enhedens levetid. Kredit:KAUST En polymer, der tidligere blev brugt t -
 Ser mod solen for at skabe brintbrændstofEn kunstnerisk gengivelse af grænsefladen mellem et fotoabsorberende materiale og en vandig elektrolyt. Kredit:Lawrence Livermore National Laboratory Da Lawrence Livermore-forskeren Tadashi Ogitsu
Ser mod solen for at skabe brintbrændstofEn kunstnerisk gengivelse af grænsefladen mellem et fotoabsorberende materiale og en vandig elektrolyt. Kredit:Lawrence Livermore National Laboratory Da Lawrence Livermore-forskeren Tadashi Ogitsu
- Hvor mantceller er vi lavet af?
- Sådan konverteres Kilopascals til Joules
- Billede:Kosmisk neonlys
- Jordens toksiske niveauer for det meste mindre efter Marshall-branden i Boulder, Colorado
- Hvor mange planeter og dværg er der i solsystemet?
- To bølger mødes på samme tid, når man har en øjeblikkelig amplitude af A og andre B deres kombi…


