Hvorfor forekommer kemisk reaktion hurtigere ved en højere temperatur?
1. Øget kollisionsfrekvens:
* hyppigere kollisioner: Ved højere temperaturer bevæger molekyler sig hurtigere og har mere kinetisk energi. Denne øgede bevægelse fører til hyppigere kollisioner mellem reaktantmolekyler. Flere kollisioner betyder flere muligheder for reaktanter til at interagere og danne produkter.
* øget kollisions energi: Der er ikke kun flere kollisioner, men kollisionerne er også mere energiske. Dette er afgørende, for for at en reaktion kan forekomme, skal de kolliderende molekyler have nok energi til at overvinde aktiveringsenergibarrieren.
2. Øget aktiveringsenergi:
* Aktiveringsenergi: Dette er den mindste mængde energi, der kræves for at en reaktion kan forekomme. Ved højere temperaturer har flere molekyler nok energi til at overgå denne barriere.
* mere succesrige kollisioner: Mens der sker flere kollisioner, er nøglefaktoren antallet af * succesrige * kollisioner. Dette er kollisioner, hvor molekyler har nok energi til at overvinde aktiveringsenergien og danne produkter.
Analogi:
Forestil dig en gruppe mennesker, der prøver at klatre op på en bakke. Bakken repræsenterer aktiveringsenergien. Nogle mennesker (molekyler) har nok energi til at klatre op på den, mens andre ikke gør det. Hvis du øger temperaturen (give alle mere energi), vil flere mennesker have energi til at klatre op i bakken, og flere mennesker når toppen (produkter).
Kortfattet:
Højere temperaturer fører til hurtigere reaktioner ved at øge både hyppigheden af kollisioner mellem reaktantmolekyler og sandsynligheden for, at disse kollisioner vil have nok energi til at overvinde aktiveringsenergibarrieren.
Sidste artikelHvad er reaktionen mellem potassium thiocyanat andferric chlorid?
Næste artikelHvad er ligningen for kaliumbromid og vand?
 Varme artikler
Varme artikler
-
 Aerogel integreret træ giver bedre isolering end eksisterende plastbaserede materialerEt nærbillede af aerogelen til isolering, udviklet af træcellulose. Kredit:Jonas Garemark/Wallenberg Wood Science Center, KTH Royal Institute of Technology En dag snart kan bygninger blive mere ene
Aerogel integreret træ giver bedre isolering end eksisterende plastbaserede materialerEt nærbillede af aerogelen til isolering, udviklet af træcellulose. Kredit:Jonas Garemark/Wallenberg Wood Science Center, KTH Royal Institute of Technology En dag snart kan bygninger blive mere ene -
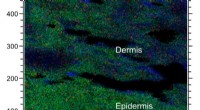 Ny metode kortlægger kemikalier i huden3-D billeddannelse af en hudsektion, hvor nikkelindholdet måles. Det røde område repræsenterer tilstedeværelsen af nikkel. Kredit:Per Malmberg En ny metode til at undersøge huden kan reducere an
Ny metode kortlægger kemikalier i huden3-D billeddannelse af en hudsektion, hvor nikkelindholdet måles. Det røde område repræsenterer tilstedeværelsen af nikkel. Kredit:Per Malmberg En ny metode til at undersøge huden kan reducere an -
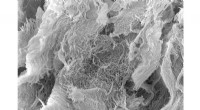 Hydrogel med langsom frigivelse hjælper immunterapi mod kræftEn syntetisk, injicerbar hydrogel udviklet ved Rice University øgede toksiciteten af en ny klasse af kræftbekæmpende immunterapimedicin. Dette scanningselektronmikroskopibillede viser de selvsamlede
Hydrogel med langsom frigivelse hjælper immunterapi mod kræftEn syntetisk, injicerbar hydrogel udviklet ved Rice University øgede toksiciteten af en ny klasse af kræftbekæmpende immunterapimedicin. Dette scanningselektronmikroskopibillede viser de selvsamlede -
 Hvordan en krystallinsk svamp udskiller vandmolekylerEt mikroskopbillede, der viser en porøs, krystallinsk materiale kaldet en metal-organisk ramme, eller MOF (materialet i lilla). Denne MOF er lavet af kobolt(II)sulfatheptahydrat, 5-aminoisophthalsyre
Hvordan en krystallinsk svamp udskiller vandmolekylerEt mikroskopbillede, der viser en porøs, krystallinsk materiale kaldet en metal-organisk ramme, eller MOF (materialet i lilla). Denne MOF er lavet af kobolt(II)sulfatheptahydrat, 5-aminoisophthalsyre
- Hvordan bruger forskere videnskabelig notation?
- Hvad kalder du steder, hvor klipper er komprimeret til bøjninger ved at kolidere plader?
- Hvordan guldsmede retter sig, når de falder på hovedet
- DNA nanorobot udløser målrettede terapeutiske reaktioner
- Hvad har mennesker brug for for at få energi til at vokse?
- Hvad er et uorganisk sediment for jordvidenskab?


