Hvad er reaktionen mellem potassium thiocyanat andferric chlorid?
reaktionen
* reaktanter: Kaliumthiocyanat (KSCN) og ferricchlorid (fecl₃)
* Produkter: Jern (III) thiocyanat ([Fe (SCN)] ²⁺) og kaliumchlorid (KCL)
Ligning
`` `
Fecl₃ (aq) + 3kscn (aq) → [Fe (SCN)] ³⁺ (aq) + 3kcl (aq)
`` `
Forklaring
1. Kompleks dannelse: Når kaliumthiocyanat tilsættes til en opløsning af jernchlorid, reagerer jernet (III) -ioner (Fe³⁺) med thiocyanationer (SCN⁻) for at danne en kompleks ion kaldet jern (III) thiocyanat ([Fe (SCN)] ³⁺). Denne komplekse ion er ansvarlig for den blodrøde farve.
2. ligevægt: Reaktionen er en ligevægtsreaktion, hvilket betyder, at den kan fortsætte i begge retninger. Dannelsen af det røde kompleks favoriseres, men det kan vendes ved at tilsætte flere chloridioner (CL⁻) til opløsningen.
nøgleobservationer
* farveændring: Opløsningen drejer blodrød på grund af dannelsen af jern (III) thiocyanatkomplekset.
* reversibilitet: Farveændringen er reversibel. Tilsætning af overskydende chloridioner kan flytte ligevægten tilbage mod reaktanterne, hvilket får den røde farve til at falme.
applikationer
* Kemisk analyse: Denne reaktion anvendes i analytisk kemi til at detektere tilstedeværelsen af jern (III) -ioner.
* spektrofotometri: Intensiteten af den røde farve kan bruges til at bestemme koncentrationen af jern (III) -ioner i en opløsning.
Sikkerhedsnotat: Ferrichlorid og kaliumthiocyanat er begge kemikalier, der skal håndteres med omhu i laboratorieindstillinger. Brug altid passende sikkerhedsudstyr, følg ordentlige laboratorieprocedurer og bortskaffer kemikalier ansvarligt.
Sidste artikelHvad er atomradius af svovl?
Næste artikelHvorfor forekommer kemisk reaktion hurtigere ved en højere temperatur?
 Varme artikler
Varme artikler
-
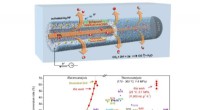 Ny sølv hulfiber booster CO2-elektroreduktionSkematisk illustration af hulfiberelektrode til at øge CO2-reduktionen til CO. Kredit:SARI Et forskerhold ledet af Profs. Wei Wei og Chen Wei fra Shanghai Advanced Research Institute (SARI) fra det
Ny sølv hulfiber booster CO2-elektroreduktionSkematisk illustration af hulfiberelektrode til at øge CO2-reduktionen til CO. Kredit:SARI Et forskerhold ledet af Profs. Wei Wei og Chen Wei fra Shanghai Advanced Research Institute (SARI) fra det -
 Ultraviolet lys-baseret belægning viser løfte i selvdesinficerende overflader i medicinske facilit…Kredit:CC0 Public Domain Verdenssundhedsorganisationen advarer om, at antibiotikaresistens er en af de største globale trusler og forudsiger, at verdensomspændende dødsrater fra denne trussel ka
Ultraviolet lys-baseret belægning viser løfte i selvdesinficerende overflader i medicinske facilit…Kredit:CC0 Public Domain Verdenssundhedsorganisationen advarer om, at antibiotikaresistens er en af de største globale trusler og forudsiger, at verdensomspændende dødsrater fra denne trussel ka -
 Kompositmaterialets egenskaber til konstruktion af pålidelige togKompositmaterialer bliver stadig mere populære. Et af de primære kompositmaterialer til moderne strukturer er glasfiberforstærket plast (GFRP), som normalt bruges inden for luftfart, moderne transport
Kompositmaterialets egenskaber til konstruktion af pålidelige togKompositmaterialer bliver stadig mere populære. Et af de primære kompositmaterialer til moderne strukturer er glasfiberforstærket plast (GFRP), som normalt bruges inden for luftfart, moderne transport -
 Ny test giver nøjagtige mål for DNA-skader fra kemiske forbindelserKredit:CC0 Public Domain En ny biomarkørtest udviklet af forskere ved Georgetown Lombardi Comprehensive Cancer Center og deres kolleger kan hjælpe med at forudsige, med op til 90 procent sikkerhed
Ny test giver nøjagtige mål for DNA-skader fra kemiske forbindelserKredit:CC0 Public Domain En ny biomarkørtest udviklet af forskere ved Georgetown Lombardi Comprehensive Cancer Center og deres kolleger kan hjælpe med at forudsige, med op til 90 procent sikkerhed
- Hvilket er det system, der består af sol og genstande, drejer sig om det?
- Hvad er teorien, der forklarer, hvordan ny skorpe dannede sig langs en stor revne i havbund?
- Bakterier, der er nyttige for økosystemet?
- Forskellen mellem afhjælpning og intervention i matematik
- Hvad sker der med dampen, da den frigiver termisk energi inde i radiator?
- Hvordan er de empiriske og molekylære formler for en kompateret relateret?


