Hvordan er de empiriske og molekylære formler for en kompateret relateret?
Empirisk formel:
* Repræsenterer det enkleste forhold mellem hele antal atomer i en forbindelse.
* Viser det relative antal af hver type atom, der er til stede.
* Afspejler ikke nødvendigvis det faktiske antal atomer i et molekyle.
molekylær formel:
* Repræsenterer det faktiske antal atomer i hvert element i et molekyle af forbindelsen.
* Er et multiplum af den empiriske formel.
forhold:
* Den molekylære formel er altid et multiplum med hele nummer af den empiriske formel.
* Multipel bestemmes af forbindelsens molekylvægt.
* Hvis molekylvægten er kendt, kan den molekylære formel beregnes ud fra den empiriske formel.
Eksempel:
Overvej den sammensatte glukose:
* Empirisk formel: Ch₂o
* molekylær formel: C₆h₁₂o₆
Den molekylære formel (c₆h₁₂o₆) er seks gange den empiriske formel (CH₂O). Dette skyldes, at molekylvægten af glukose er 180 g/mol, hvilket er seks gange den empiriske formelvægt på 30 g/mol.
Kortfattet:
Den empiriske formel tilvejebringer den grundlæggende byggesten af en forbindelse, mens den molekylære formel giver den komplette sammensætning af et molekyle. Den molekylære formel er altid et multiplum af den empiriske formel, og multipelet bestemmes af molekylvægten.
Sidste artikelHvad er den molekylære formel for doxycyclinhyclat?
Næste artikelHvad giver strontiumchlorid og natriumsulfat?
 Varme artikler
Varme artikler
-
 Selvsamlende proteinfilamenter designet og bygget fra bundenNy, computerdesignede proteiner samler sig selv til filamenter mere end tusind gange tyndere end et menneskehår. Kredit:Ian C. Haydon/Institute for Protein Design For første gang, videnskabsmænd h
Selvsamlende proteinfilamenter designet og bygget fra bundenNy, computerdesignede proteiner samler sig selv til filamenter mere end tusind gange tyndere end et menneskehår. Kredit:Ian C. Haydon/Institute for Protein Design For første gang, videnskabsmænd h -
 En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore
En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore -
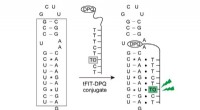 Ny måde at identificere influenza A-virus lyser op, når specifikke virusmål er til stedeSkematisk illustration af fluorescensføling af panhandle-strukturen af IAV RNA-promotorregionen (angivet i boksen). Kredit:tFIT-DPQ sonde. Influenza A-virus, som er ansvarlig for sæsonbestemte in
Ny måde at identificere influenza A-virus lyser op, når specifikke virusmål er til stedeSkematisk illustration af fluorescensføling af panhandle-strukturen af IAV RNA-promotorregionen (angivet i boksen). Kredit:tFIT-DPQ sonde. Influenza A-virus, som er ansvarlig for sæsonbestemte in -
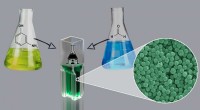 Kemikere udvikler metode til at opnå katalysator-, overfladeaktive og skabelonfrie polymere nanopar…Reaktion udviklet af RUDN -kemikere indeholder to monomerer - 3 -aminophenol og formaldehyd. Kredit:Allen Dressen En kemiker fra RUDN foreslår en simpel teknologi til fremstilling af polymere nano
Kemikere udvikler metode til at opnå katalysator-, overfladeaktive og skabelonfrie polymere nanopar…Reaktion udviklet af RUDN -kemikere indeholder to monomerer - 3 -aminophenol og formaldehyd. Kredit:Allen Dressen En kemiker fra RUDN foreslår en simpel teknologi til fremstilling af polymere nano
- Hvilke to typer græsarealer er der?
- Mere end en million ramt af monsunoversvømmelser i Indien
- Ind i maven på roveren:VIPERs sidste videnskabelige instrument installeret
- Nanostruktur komplekse materialer modellering
- Superkrystal:En skjult fase af stof skabt af et lysudbrud
- Fattige samfund er hårdest ramt af giftig forurening


