Hvilke strukturer holdes sammen af brintbindinger?
i biologi:
* Vand: Hydrogenbindinger er den primære kraft, der holder vandmolekyler sammen. De er ansvarlige for vandets høje kogepunkt, overfladespænding og evne til at opløse mange polære molekyler.
* Proteiner: Hydrogenbindinger hjælper med at stabilisere de sekundære, tertiære og kvartære strukturer af proteiner. De danner mellem aminosyrerester i en polypeptidkæde og mellem forskellige polypeptidkæder.
* DNA og RNA: Hydrogenbindinger holder de to DNA -tråde sammen og danner den dobbelte helix. De hjælper også med at stabilisere strukturen af RNA.
* cellulose: De lineære kæder af glukosemolekyler i cellulose holdes sammen af brintbindinger, hvilket giver den sin stive struktur.
* enzymer: Hydrogenbindinger hjælper med at danne det aktive sted for enzymer og binde underlag til enzymet.
i kemi:
* is: Hydrogenbindingerne mellem vandmolekyler i is er stærkere end i flydende vand, hvilket får molekylerne til at danne en mere ordnet, krystallinsk struktur.
* flydende krystaller: Nogle flydende krystaller danner deres bestilte strukturer på grund af hydrogenbinding.
Generelle eksempler:
* kulhydrater: Hydrogenbindinger bidrager til strukturen og egenskaberne af kulhydrater, som stivelse og glycogen.
* polymerer: Hydrogenbindinger kan forekomme mellem polymerkæder, hvilket påvirker deres egenskaber som styrke og fleksibilitet.
Det er vigtigt at bemærke, at brintbindinger ikke er så stærke som kovalente bindinger, men deres kollektive virkning kan være signifikant til at bestemme strukturen og egenskaberne for mange molekyler og materialer.
Sidste artikelHvilke syrer indeholder fluor- og iodidanioner?
Næste artikelHvilket stof fryser ved en temperatur på 15 grader C?
 Varme artikler
Varme artikler
-
 Løsningsbehandlede OLED'er baner vejen for fremtidige belysningsapplikationerKredit:Shutterstock Før det kan overtage vores gader og hjem, OLED-belysning skal gøres mere tilgængelig. SOLEDLIGHT-projektet har udviklet nye flerlags OLEDer takket være en ny proces, der lover
Løsningsbehandlede OLED'er baner vejen for fremtidige belysningsapplikationerKredit:Shutterstock Før det kan overtage vores gader og hjem, OLED-belysning skal gøres mere tilgængelig. SOLEDLIGHT-projektet har udviklet nye flerlags OLEDer takket være en ny proces, der lover -
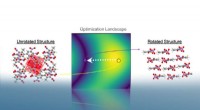 Molekylære krystalstrukturer pakker det indAutopack roterer krystalstrukturer i 3D-rum for at minimere deres molekylers projicerede areal. Efter konvergens, det er muligt at udtrække krystallens tilhørende pakningsmotiv baseret på relative int
Molekylære krystalstrukturer pakker det indAutopack roterer krystalstrukturer i 3D-rum for at minimere deres molekylers projicerede areal. Efter konvergens, det er muligt at udtrække krystallens tilhørende pakningsmotiv baseret på relative int -
 For en lav-kulstof cement opskrift, videnskabsmænd kigger på jordens gryderScanning Electron Microscope billede af den cementholdige matrix af en brudsten. Cement betragtes som et net af sammenflettede fibre, når det afbildes i nanoskala. Kredit:Udlånt af Shalev Siman-Sov, S
For en lav-kulstof cement opskrift, videnskabsmænd kigger på jordens gryderScanning Electron Microscope billede af den cementholdige matrix af en brudsten. Cement betragtes som et net af sammenflettede fibre, når det afbildes i nanoskala. Kredit:Udlånt af Shalev Siman-Sov, S -
 Opdagelse kan føre til et nyt katalysatordesign for at reducere nitrogenoxider i dieseludstødningDette diagram viser en ny reaktionsmekanisme, der kan bruges til at forbedre katalysatordesign til forureningsbekæmpelsessystemer til dieseludstødning. Kredit:Purdue University /Maureen Lifton For
Opdagelse kan føre til et nyt katalysatordesign for at reducere nitrogenoxider i dieseludstødningDette diagram viser en ny reaktionsmekanisme, der kan bruges til at forbedre katalysatordesign til forureningsbekæmpelsessystemer til dieseludstødning. Kredit:Purdue University /Maureen Lifton For
- Hvad er formlen for forbindelse dannet mellem ioner CO2 og NO2-?
- Lysemitterende MXene kvanteprikker
- Forhandlinger om en global plasttraktat genoptages i Canada
- Ny forskning forudsiger nøjagtigt det australske hvedeudbytte måneder før høst
- Hvorfor får fugt mit hår til at kruse?
- Relationer, ikke overbelastning af træning, hovedårsagen til, at børn holder op med konkurrencesv…


