Hvilket element har lignende egenskaber som svovl?
Her er grunden til, at elementer i den samme gruppe har lignende egenskaber:
* samme antal valenselektroner: Elementer i den samme gruppe har det samme antal elektroner i deres yderste skal (valenselektroner). Disse elektroner er dem, der er involveret i kemisk binding, som stort set bestemmer elementets reaktivitet og hvordan det danner forbindelser.
* Lignende kemisk opførsel: På grund af det samme antal valenselektroner har elementer i den samme gruppe en tendens til at dele lignende kemiske egenskaber. De danner lignende typer forbindelser og reagerer ofte på lignende måder.
elementer med lignende egenskaber som svovl er:
* ilt (O): Den mest rigelige chalcogen. Det er også en ikke -metal og danner forbindelser med mange elementer, inklusive svovl.
* selen (SE): En metalloid med egenskaber, der ligner svovl. Det bruges til fotokopiering og andre industrielle applikationer.
* tellurium (TE): En metalloid, der er mindre reaktiv end svovl. Det bruges i legeringer og solcellepaneler.
* polonium (PO): En radioaktiv metalloid. Det er meget sjældent og meget giftigt.
Så mens hvert element i Chalcogen -gruppen har sine egne unikke egenskaber, deler de mange ligheder på grund af deres fælles elektronkonfiguration.
Sidste artikelHvad er formlen for forbindelse, hvor atomkombinationsforhold er silicium ilt 1 2?
Næste artikelHvad er atomnummeret i O2?
 Varme artikler
Varme artikler
-
 Hudgel tillader sår at hele uden at efterlade et arKredit: Biomater. Sci ., 2018, 6, 2859-2870 Et team af forskere ved Huazhong University of Science and Technology har udviklet en silkeproteinbaseret gel, som de hævder giver mulighed for hudheli
Hudgel tillader sår at hele uden at efterlade et arKredit: Biomater. Sci ., 2018, 6, 2859-2870 Et team af forskere ved Huazhong University of Science and Technology har udviklet en silkeproteinbaseret gel, som de hævder giver mulighed for hudheli -
 Forskere beskriver strukturer, mekanismer, der gør det muligt for bakterier at modstå antibiotikaEt bånddiagram over den tredelte effluxpumpe fra Campylobacter jejuni bakterie. Kredit:Edward Yu/Iowa State University To nye opdagelser fra Edward Yus laboratorium ved Iowa State University til
Forskere beskriver strukturer, mekanismer, der gør det muligt for bakterier at modstå antibiotikaEt bånddiagram over den tredelte effluxpumpe fra Campylobacter jejuni bakterie. Kredit:Edward Yu/Iowa State University To nye opdagelser fra Edward Yus laboratorium ved Iowa State University til -
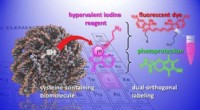 Nye kemiske værktøjer til at modificere og studere biomolekylerEn illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL) Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udvikl
Nye kemiske værktøjer til at modificere og studere biomolekylerEn illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL) Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udvikl -
 En vandspaltende katalysator ulig nogen andenKredit:CC0 Public Domain Elektricitet kan genereres af vedvarende kilder som sollys og vind, derefter brugt til at spalte vand, som gør brint som brændstof til nye energienheder såsom brændselscel
En vandspaltende katalysator ulig nogen andenKredit:CC0 Public Domain Elektricitet kan genereres af vedvarende kilder som sollys og vind, derefter brugt til at spalte vand, som gør brint som brændstof til nye energienheder såsom brændselscel
- Polen afviser EU-beviser om urskovsstridigheder
- Kan vi genoplive thylacinen? Måske, men det hjælper ikke den globale udryddelseskrise
- Hvad indikerer et produktkonstant med lav opløselighed i forbindelse med forbindelse?
- Funktionaliseret grafenoxid spiller en rolle i næste generations oliebrøndsborevæsker
- Hvad er det modsatte ord for energisk?
- Menneskeheden helede ozonhullet. Kan vi gøre det samme for klimaforandringerne?


