Hvad danner KCL og AGNO3?
* sølvchlorid (AGCL): Dette er et hvidt bundfald (fast), der er uopløseligt i vand.
* kaliumnitrat (KNO3): Dette er et opløseligt salt, der forbliver i opløsning.
Reaktionsligningen er:
KCL (AQ) + AGNO3 (AQ) → AGCL (S) + KNO3 (AQ)
Her er hvorfor dette sker:
* Dobbeltfortrængning: De positive og negative ioner i de to reaktanter skifter partnere. Kalium (K+) -ionen fra KCl kombineres med nitratet (NO3-) -ionen fra AgNO3 til dannelse af KnO3, og sølv (Ag+) ion fra AgNO3 kombineres med chlorid (Cl-) ion fra KCl til dannelse af AgCl.
* opløselighed: AGCL er et meget almindeligt eksempel på et bundfald. Det dannes, fordi det er uopløseligt i vand, hvilket betyder, at det ikke opløses let. KNO3 er på den anden side opløselig i vand og forbliver opløst som ioner.
Denne reaktion bruges ofte i kemi -demonstrationer til at illustrere nedbørreaktioner og til at undervise om opløselighedsregler.
Sidste artikelHvad er forholdet mellem zink og klor i chlorid?
Næste artikelHvad er den ioniske ligning mellem halogenider og sølvnitrat?
 Varme artikler
Varme artikler
-
 Forskere fremmer biomassetransformationsprocessen(A) Dette er en foreslået reaktionsvej, der fører til 4-HPO. (B) Dette er 4-HPO-udnyttelse. Kredit:DICP Biomasse kan tjene som en vedvarende kilde til både energi og kulstof. Acetone, n-butanol, o
Forskere fremmer biomassetransformationsprocessen(A) Dette er en foreslået reaktionsvej, der fører til 4-HPO. (B) Dette er 4-HPO-udnyttelse. Kredit:DICP Biomasse kan tjene som en vedvarende kilde til både energi og kulstof. Acetone, n-butanol, o -
 Hemmeligheder bag Lucretia maler tættere på at blive afsløretLucretias død. Kredit:Bowes Museum Mysteriet om hvem der malede et århundreder gammelt kunstværk, og når, er tættere på at blive afsløret takket være kunstbevaring og retsmedicinske eksperter fra
Hemmeligheder bag Lucretia maler tættere på at blive afsløretLucretias død. Kredit:Bowes Museum Mysteriet om hvem der malede et århundreder gammelt kunstværk, og når, er tættere på at blive afsløret takket være kunstbevaring og retsmedicinske eksperter fra -
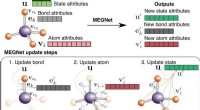 Ingeniører bruger grafnetværk til nøjagtigt at forudsige egenskaber af molekyler og krystallerSkematisk illustration af MEGNet-modeller. Kredit:Chi Chen/Materials Virtual Lab Nanoingeniører ved University of California San Diego har udviklet nye deep learning-modeller, der præcist kan foru
Ingeniører bruger grafnetværk til nøjagtigt at forudsige egenskaber af molekyler og krystallerSkematisk illustration af MEGNet-modeller. Kredit:Chi Chen/Materials Virtual Lab Nanoingeniører ved University of California San Diego har udviklet nye deep learning-modeller, der præcist kan foru -
 Ny eksfolieringsteknik genvinder biomaterialers piezoelektricitetZhang Zhuomin, et medlem af Dr. Yang Zhengbaos forskerhold, demonstrerer råmaterialet i tyndtarmens submucosa fra får. Kredit:City University of Hong Kong Piezoelektriske materialer er anvendelige
Ny eksfolieringsteknik genvinder biomaterialers piezoelektricitetZhang Zhuomin, et medlem af Dr. Yang Zhengbaos forskerhold, demonstrerer råmaterialet i tyndtarmens submucosa fra får. Kredit:City University of Hong Kong Piezoelektriske materialer er anvendelige
- Hvad lærte Elsa Albert Einstein?
- At komme ind på arbejdsmarkedet i en recession kan tage år af dit liv, undersøgelse finder
- Hvordan kan elektricitet opnås fra kemisk energi, der er opbevaret i brændstof?
- Hvad laver en syre plus base?
- Hvis et vakuum har hyppighed på 1.01000000000000000000, hvad er bølgelængden?
- Tvangssteriliseringer af indfødte kvinder:Endnu et folkedrab


