Hvorfor er svovl og oxyger i den samme gruppe 6A?
Her er grunden til, at de er grupperet sammen:
* Lignende elektronisk konfiguration: Både ilt og svovl har seks valenselektroner (elektroner i deres yderste skal). Dette betyder, at de har det samme antal elektroner til rådighed til binding.
* Lignende kemiske egenskaber: Denne delte elektronkonfiguration fører til lignende kemisk opførsel. Begge elementer:
* Har en tendens til at få to elektroner for at opnå en stabil oktetkonfiguration.
* Form oxider (forbindelser med ilt).
* Udviser ofte oxidationstilstande på -2.
* Kan danne kovalente bindinger med andre ikke -metaller.
* Lignende reaktivitet: Mens ilt er meget reaktivt, er svovl mindre, men de deler begge en tendens til at deltage i kemiske reaktioner.
Kort sagt er det lignende antal valenselektroner og de resulterende kemiske egenskaber, der stammer fra denne delte elektroniske konfiguration, de primære årsager til, at svovl og ilt grupperes i gruppe 6A for den periodiske tabel.
Sidste artikelEr den største mængde gas i luft ilt?
Næste artikelBestem antallet af iltatomer, der er til stede i 25,0 g kuldioxid?
 Varme artikler
Varme artikler
-
 Forskere udvikler en optisk fiber fremstillet af gel afledt af havalgerSpiselig, biokompatibel og bionedbrydeligt, disse fibre har potentiale til forskellige medicinske anvendelser. Kredit:Eric Fujiwara En optisk fiber fremstillet af agar er blevet produceret ved Uni
Forskere udvikler en optisk fiber fremstillet af gel afledt af havalgerSpiselig, biokompatibel og bionedbrydeligt, disse fibre har potentiale til forskellige medicinske anvendelser. Kredit:Eric Fujiwara En optisk fiber fremstillet af agar er blevet produceret ved Uni -
 Sammensætning styrer biologisk ur med lysFigur:Burforbindelser regulerer det cirkadiske ur med lys (billede af Issei Takahashi, Nagoya Universitet) Forskere ved Japans Institute of Transformative Bio-Molecules (ITbM) ved Nagoya Universit
Sammensætning styrer biologisk ur med lysFigur:Burforbindelser regulerer det cirkadiske ur med lys (billede af Issei Takahashi, Nagoya Universitet) Forskere ved Japans Institute of Transformative Bio-Molecules (ITbM) ved Nagoya Universit -
 Teamet opdager protein, lipidforbindelse, der kan hjælpe nye influenzabehandlingerKredit:University of Maine Forbindelsen mellem et influenzavirusoverfladeprotein og et værtscellelipid er blevet opdaget af forskere ved University of Maine og National Institutes of Health. Bekræ
Teamet opdager protein, lipidforbindelse, der kan hjælpe nye influenzabehandlingerKredit:University of Maine Forbindelsen mellem et influenzavirusoverfladeprotein og et værtscellelipid er blevet opdaget af forskere ved University of Maine og National Institutes of Health. Bekræ -
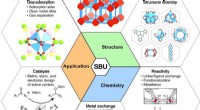 Sekundære bygningsenheder (SBU'er) - vendepunktet i udviklingen af metal-organiske rammer (MOF'er…Indvirkningen af SBU på strukturen, kemi og anvendelser af MOFer. Den rige kemiske arkitektur af MOFer er baseret på SBUernes strukturelle mangfoldighed - hvilket gør MOFer mekanisk og arkitektonisk
Sekundære bygningsenheder (SBU'er) - vendepunktet i udviklingen af metal-organiske rammer (MOF'er…Indvirkningen af SBU på strukturen, kemi og anvendelser af MOFer. Den rige kemiske arkitektur af MOFer er baseret på SBUernes strukturelle mangfoldighed - hvilket gør MOFer mekanisk og arkitektonisk
- Brugerdefinerede sekvenser til polymerer ved hjælp af synligt lys
- I 1968, Apollo 8 realiserede de 2, 000 år gammel drøm om en romersk filosof
- Hvordan opvarmer solen jord ujævnt?
- Hvor mange centimeter er 33 millimeter?
- Forklarer:Topsy-turvy vejr kommer fra polar vortex
- Hvilket element bruges af de fleste atomkraftværker til at producere energi?


