Hvis 1,164 g jernfyldninger reagerer med chlorgas for at give 3,384 g chlorid, hvad er den empiriske formelforbindelse til molforholdsmetode.?
1. Beregn massen af klor:
* Mass af klor =Masse af jernchlorid - Masse af jern
* Masse klor =3,384 g - 1.164 g =2,220 g
2. Beregn molen for hvert element:
* Mol jern (Fe) =masse af Fe / molmasse af Fe =1,164 g / 55,845 g / mol =0,0208 mol
* Mol klor (CL) =masse af Cl / molær masse af Cl =2,220 g / 35,453 g / mol =0,0626 mol
3. Bestem molforholdet:
* Opdel molen for hvert element med det mindste antal mol:
* FE:0,0208 mol / 0,0208 mol =1
* Cl:0,0626 mol / 0,0208 mol =3
4. Skriv den empiriske formel:
* Molforholdet indikerer, at den empiriske formel for jernchloridforbindelsen er fecl₃ .
 Varme artikler
Varme artikler
-
 Næste generations 3D-trykte katalysatorer til at drive hypersonisk flyvningUdviklet som en del af NASAs Hyper-X-program, X-43A hypersonisk forskningskøretøj lavede luftfartshistorie i 2004, når hastigheder over Mach 9,6 eller over 10, 000 km/t. Kredit:NASA Ultraeffektive
Næste generations 3D-trykte katalysatorer til at drive hypersonisk flyvningUdviklet som en del af NASAs Hyper-X-program, X-43A hypersonisk forskningskøretøj lavede luftfartshistorie i 2004, når hastigheder over Mach 9,6 eller over 10, 000 km/t. Kredit:NASA Ultraeffektive -
 Video:Det tusind år gamle ægKredit:The American Chemical Society århundredes æg, eller pidan, er en konserveret mad fremstillet ved at gære andeæg i alkali. Den grønne og sorte farve på disse æg er ikke særlig tiltalende ved
Video:Det tusind år gamle ægKredit:The American Chemical Society århundredes æg, eller pidan, er en konserveret mad fremstillet ved at gære andeæg i alkali. Den grønne og sorte farve på disse æg er ikke særlig tiltalende ved -
 Ideel metode til hurtig sygdomstestningKredit:Pixabay I den pandemiske tidsalder med telesundhed og nye teknologier, remote site lab eller point-of-care (POC) test af biovæsker er en potentielt hurtig og ikke-invasiv måde at teste for
Ideel metode til hurtig sygdomstestningKredit:Pixabay I den pandemiske tidsalder med telesundhed og nye teknologier, remote site lab eller point-of-care (POC) test af biovæsker er en potentielt hurtig og ikke-invasiv måde at teste for -
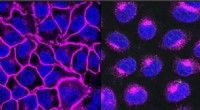 Kemikere laver molekylære skalpeller for at fjerne uønskede proteiner fra celleoverfladerEGFR, et protein, der er vigtigt for at hjælpe kræftformer med at vokse, vist her i lilla, dekorerer celleoverfladen (venstre). Efter behandling med en EGFR-målrettet LYTAC, alt EGFR-protein transport
Kemikere laver molekylære skalpeller for at fjerne uønskede proteiner fra celleoverfladerEGFR, et protein, der er vigtigt for at hjælpe kræftformer med at vokse, vist her i lilla, dekorerer celleoverfladen (venstre). Efter behandling med en EGFR-målrettet LYTAC, alt EGFR-protein transport
- Er Venus lysere end Jupiter på nattehimlen?
- Nyt datalagringsmateriale bevarer sine specielle magnetiske egenskaber selv ved stuetemperatur
- Geofysisk undersøgelse sigter mod at afsløre, hvordan vegetation reagerer på klimaændringer
- Hvad er det accepterede navn på teori, der forklarer dannelse af vores univers?
- Bruges brom i nogen giftstoffer?
- Hvordan bæredygtigt landbrug


