I reaktionen 2 Fe plus 3 S --- Fe2S3 Hvor meget, der kræves for at reagere med 48,0 g svovl?
1. Konverter gram svovl til mol:
* Find den molære masse af svovl (r):32,06 g/mol
* Opdel massen af svovl med dens molære masse:48,0 g / 32,06 g / mol =1,50 mol s
2. Brug molforholdet fra den afbalancerede ligning:
* Den afbalancerede ligning fortæller os, at 2 mol Fe reagerer med 3 mol S.
* Opret en andel for at finde de nødvendige mol af Fe:(2 mol Fe / 3 mol s) =(x mol Fe / 1,50 mol s)
* Løs for x:x =1,00 mol Fe
3. Konverter mol af jern til gram:
* Find den molære masse af jern (Fe):55,845 g/mol
* Multiplicer molen af Fe med dens molære masse:1,00 mol Fe * 55,845 g/mol =55,8 g Fe
Derfor kræves 55,8 gram jern for at reagere med 48,0 gram svovl.
 Varme artikler
Varme artikler
-
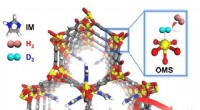 Udvikling af smart isotopadskillelsessystemMOF-74-IM. Kredit:UNIST Et internationalt team af forskere, tilknyttet UNIST har præsenteret et nyt hydrogenisotopseparationssystem baseret på et porøst metal organisk rammeværk (MOF). Isoleringen
Udvikling af smart isotopadskillelsessystemMOF-74-IM. Kredit:UNIST Et internationalt team af forskere, tilknyttet UNIST har præsenteret et nyt hydrogenisotopseparationssystem baseret på et porøst metal organisk rammeværk (MOF). Isoleringen -
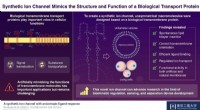 Forskere syntetiserer nye kunstige molekyler, der efterligner et cellemembranproteinEn usymmetrisk molekylær struktur muliggør orienteret indsættelse af den syntetiske amfifil til et dobbeltlag ved tilsætning til en præformet membran. Kompleksation med en ligand tilskynder iontranspo
Forskere syntetiserer nye kunstige molekyler, der efterligner et cellemembranproteinEn usymmetrisk molekylær struktur muliggør orienteret indsættelse af den syntetiske amfifil til et dobbeltlag ved tilsætning til en præformet membran. Kompleksation med en ligand tilskynder iontranspo -
 Opdagelse af, hvordan amyloider binder metalioner kaster lys over proteinets funktion”Selvom der har været en masse højopløsninger, atomært strukturarbejde på amyloider ved faststof-NMR, mennesker har virkelig ikke undersøgt de metalbindende aspekter, ”Siger professor Mei Hong. Kredit
Opdagelse af, hvordan amyloider binder metalioner kaster lys over proteinets funktion”Selvom der har været en masse højopløsninger, atomært strukturarbejde på amyloider ved faststof-NMR, mennesker har virkelig ikke undersøgt de metalbindende aspekter, ”Siger professor Mei Hong. Kredit -
 Kaffeforfalskning afdækket ved hjælp af ny metodeKredit:Quadram Institute Forskere fra Quadram Institute har udviklet en ny teknik til at skelne mellem overlegen Arabica -kaffe og billigere, lavere kvalitet Robusta. Ved hjælp af den nye teknik,
Kaffeforfalskning afdækket ved hjælp af ny metodeKredit:Quadram Institute Forskere fra Quadram Institute har udviklet en ny teknik til at skelne mellem overlegen Arabica -kaffe og billigere, lavere kvalitet Robusta. Ved hjælp af den nye teknik,
- Hvordan finder man ud af et atoms kerneladning?
- Hvad er de faktorer, der påvirker en lederes modstand?
- Hvorfor kan du se lag i folierede klipper, men ikke ikke -folierede klipper?
- Nukleart brændsel fjernet fra det lamme Japan -anlæg
- Når temperaturen af en gas med fast volumen stiger, vil trykket?
- Sådan konverteres gram per meter Squared til pund pr. Square Foot


