Kemikere laver molekylære skalpeller for at fjerne uønskede proteiner fra celleoverflader
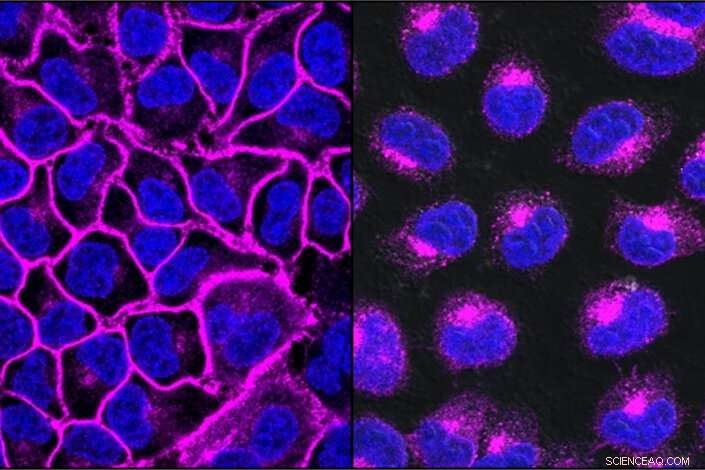
EGFR, et protein, der er vigtigt for at hjælpe kræftformer med at vokse, vist her i lilla, dekorerer celleoverfladen (venstre). Efter behandling med en EGFR-målrettet LYTAC, alt EGFR-protein transporteres ind i lysosomer, nedbrydningsrummene i cellen (til højre). Kredit:Steven Banik
Når videnskabsmænd finder et potentielt farligt protein på en celle, de forestiller sig måske at krympe sig selv for at blive små kirurger, skærer netop det problematiske molekyle ud og efterlader de sunde dele af cellen intakte. Mens behændige hænder og skarpe instrumenter aldrig ville være i stand til at udskære et enkelt protein fra overfladen af en celle, et nyt molekylært værktøj kunne gøre cellulær kirurgi lettere, ifølge en undersøgelse offentliggjort i Natur den 29. juli.
Stanford-kemikere har udviklet en ny klasse af molekyler, der transporterer uønskede proteiner fra overfladen eller det omgivende miljø af en celle ind i lysosomet, det cellulære rum dedikeret til proteinnedbrydning. Disse molekyler, kaldet lysosom-målrettede kimærer, eller LYTAC'er, arbejde ved selektivt at mærke et protein med en etiket, der forsegler dets skæbne til cellulær affaldsbortskaffelse. Denne selektive nedbrydning kan hjælpe forskere med at studere og behandle sygdomme som kræft og Alzheimers, hvis årsager er knyttet til overfladeproteiner.
"Det er ligesom en molekylær skalpel, " sagde hovedforfatter Steven Banik, en postdoc i laboratoriet hos Carolyn Bertozzi, Anne T. og Robert M. Bass Professor ved Institut for Humaniora og Naturvidenskab. "Dette værktøj giver dig mulighed for at accelerere den naturlige nedbrydning af et individuelt protein blandt alle de forskellige proteiner, der er på eller uden for en celle."
Proteiner er afgørende for mange biologiske processer som metabolisme og intercellulær kommunikation, men nogle kan også hjælpe sygdomme som kræft med at sprede sig og undgå immunregulering. Traditionelle metoder til at hæmme disse dårlige skuespillere involverer brug af lægemidler, der blokerer proteinets aktive sted, hvor andre cellulære komponenter kan docke, mens proteinet arbejder på dem, normalt ved at flytte atomer rundt. Men denne blokeringsstrategi er ufuldkommen; nogle gange er bindingslommen for lav, og inhibitoren springer for hurtigt af. Andre gange, et proteins aktivitet stammer fra dets fysiske egenskaber, som dens stivhed, og ikke fra noget aktivt websted, så blokering af en lille del af hele proteinet er utilstrækkeligt. I disse tilfælde, at dræne cellen for proteinet er den eneste mulighed.
Proteinnedbrydning som en terapeutisk strategi har været særlig populær siden udviklingen af PROTAC'er, eller proteolyse rettet mod kimærer, for 20 år siden. PROTAC'er, som opsøger og mærker intracellulære proteiner til nedbrydning, har set succes i forskningslaboratorier og i tidlige kliniske undersøgelser, men de er afhængige af en nedbrydningsvej, der er utilgængelig for de omkring 40 procent af alle proteiner, der sidder på toppen af eller uden for en cellemembran. Bertozzi og Banik accepterede ikke, at visse proteiner - og sygdomme - ville være uden for rækkevidde.
"Mit laboratorium har altid været interesseret i, hvad der sker på celleoverfladen, som indeholder alle disse proteiner, der er vigtige for immunmodulation, sagde Bertozzi, som også er Baker Family Co-Director for Stanford ChEM-H. "Vi har identificeret mange overflade- og udskilte proteiner, som vi tror spiller patogene roller i cancer, og LYTAC'er kunne hjælpe os med bedre at forstå dem og udforske dem som lægemiddelmål."
Nøglen til at få værktøjet til at fungere er dets bifunktionelle design. Den ene side af dette molekyle kan skræddersyes til at binde til ethvert protein af interesse. På den anden side er en kort aminosyresekvens, eller peptid, besat med et sukker kaldet mannose-6-phosphat.
Dette sukker tjener som bogholderi-etiket for cellen. Når cellen opbygger proteiner, der hører hjemme i lysosomet, det klæber på disse sukkerarter for at sikre, at de når deres destination. "Mannose-6-phosphat fungerer som et postnummer, " sagde Banik. "Disse sukkerarter fortæller cellen, 'Jeg tager dette protein til lysosomet. Send mig venligst derhen." Der er receptorer på celleoverfladen, der interagerer med denne sukkerbelægning, og når de griber fat i et LYTAC-molekyle og trækker det ind i cellen, de mærkede proteiner trækkes ind sammen med det.
Ved at knytte denne etiket til proteiner, LYTAC'er kaprer en naturlig cellulær shuttling-mekanisme designet til at eskortere nysyntetiserede lysosomale proteiner til deres nye hjem. Men mens lysosomale proteiner er hårde nok til at overleve de nedbrydende enzymer, de møder i lysosomet, de fleste proteiner er ikke, så dem, der er mærket med LYTAC-metoden, bliver normalt ødelagt.
Stanford-forskerne viser, at i celler, de kan målrette og nedbryde proteiner, der er vigtige ved Alzheimers sygdom og kræft. Ifølge dem, den proteinbindende ende af LYTAC kan være alt, der binder til et protein, som et antistof eller et eksisterende lægemiddel, så i fremtiden, mange andre proteiner og sygdomme kan blive angrebet.
"Med proteinnedbrydningsstrategier, du kan ikke kun udvide, hvad der kan medicineres, men også forbedre terapier, der allerede er derude, " sagde Bertozzi. "Hver celle har lysosomer. Hver celle har allerede en måde at nedbryde proteiner på. Lige meget hvad dit mål er, hvis du kan få en LYTAC der, du kan forringe det."
Sidste artikelYderligere to polymorfer fundet for rød-orange-gul
Næste artikelUdfordrer en central grundsætning i kemi
 Varme artikler
Varme artikler
-
 Forskere udvikler dobbeltlags maling, der reflekterer varmeDen dobbeltlagsbelægning forbliver køligere under sollys. Kredit:Jyotirmoy Mandal Et team af forskere fra Columbia og Howard Universiteter i USA og Peking University i Kina har udviklet en slags f
Forskere udvikler dobbeltlags maling, der reflekterer varmeDen dobbeltlagsbelægning forbliver køligere under sollys. Kredit:Jyotirmoy Mandal Et team af forskere fra Columbia og Howard Universiteter i USA og Peking University i Kina har udviklet en slags f -
 Defekt- og interfaceteknik til e-NRR under omgivelsesbetingelserSkematisk oversigt over defekt- og interfaceteknik til effektiv e-NRR elektrokatalysator. Kredit:Journal of Energy Chemistry Den elektrokemiske nitrogenreduktionsreaktion (e-NRR) under omgivelsesb
Defekt- og interfaceteknik til e-NRR under omgivelsesbetingelserSkematisk oversigt over defekt- og interfaceteknik til effektiv e-NRR elektrokatalysator. Kredit:Journal of Energy Chemistry Den elektrokemiske nitrogenreduktionsreaktion (e-NRR) under omgivelsesb -
 Neutroner undersøger iltgenererende enzym for en grønnere tilgang til rent vandKloritdismutase er et unikt oxygendannende enzym, der nedbryder chlorit, et industrielt forurenende stof, der findes globalt i grundvandet, drikkevand og jord. Forskning udført på ORNL bidrager til en
Neutroner undersøger iltgenererende enzym for en grønnere tilgang til rent vandKloritdismutase er et unikt oxygendannende enzym, der nedbryder chlorit, et industrielt forurenende stof, der findes globalt i grundvandet, drikkevand og jord. Forskning udført på ORNL bidrager til en -
 At bryde kuldioxid hurtigere, billigere, og mere effektivtEn opdagelse fra et team af forskere kunne gøre det mere muligt at omdanne kuldioxid til brændstoffer. Kredit:Steve Suib En ny katalysator nedbryder kuldioxid til nyttige kemikalier hurtigere, bil
At bryde kuldioxid hurtigere, billigere, og mere effektivtEn opdagelse fra et team af forskere kunne gøre det mere muligt at omdanne kuldioxid til brændstoffer. Kredit:Steve Suib En ny katalysator nedbryder kuldioxid til nyttige kemikalier hurtigere, bil
- Orkaner kan blive mere alvorlige - har vi brug for en helt ny kategori for at beskrive dem?
- USA reviderer passagersikkerhedsreglerne for autonome køretøjer
- Nano-forskere udvikler en ny slags bærbart vandrensningssystem
- At få gødning det rigtige sted til den rigtige hastighed
- Den anden virustrussel:stigning i cyberangreb med COVID-tema
- BMW advarer om, at overskuddet vil falde på grund af omkostninger, handelsusikkerhed


