Hvilken har et højere smeltepunkt natriumchlorid eller ethylalkohol?
* ionisk binding: Natriumchlorid er en ionisk forbindelse. Det danner et stærkt krystalgitter, der holdes sammen af elektrostatiske kræfter mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-). Disse stærke bindinger kræver meget energi for at bryde, hvilket resulterer i et højt smeltepunkt (801 ° C).
* Hydrogenbinding: Ethylalkohol er en kovalent forbindelse med hydrogenbinding. Mens hydrogenbinding er en stærk intermolekylær kraft, er den signifikant svagere end de ioniske bindinger i natriumchlorid. De svagere bindinger i ethylalkohol kræver mindre energi for at bryde, hvilket giver det et meget lavere smeltepunkt (-114 ° C).
Kortfattet: De stærke ioniske bindinger i natriumchlorid gør det til et solidt ved stuetemperatur og giver det et meget højt smeltepunkt. Ethylalkohol, med sine svagere brintbindinger, er en væske ved stuetemperatur og smelter ved en meget lavere temperatur.
 Varme artikler
Varme artikler
-
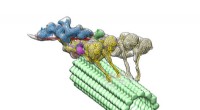 Mikroskopiske vogne leverer molekyler i vores cellerDynein-dynactin-komplekset (flerfarvet) driver ned i en mikrotubuli (grøn). De fire motordomæner er vist med gult. Dynactin (blå) udgør stilladset for at holde de to dyneiner sammen. Kredit:Danielle G
Mikroskopiske vogne leverer molekyler i vores cellerDynein-dynactin-komplekset (flerfarvet) driver ned i en mikrotubuli (grøn). De fire motordomæner er vist med gult. Dynactin (blå) udgør stilladset for at holde de to dyneiner sammen. Kredit:Danielle G -
 Vaccineingredienser kan gemme sig i små molekylebibliotekerForskerne fandt et molekyle, der kan bruges som vaccineadjuvans og styrker immunresponset, når det tilsættes en vaccine. Kredit:Mindy Takamiya/Kyoto University iCeMS Mange vacciner indeholder ingr
Vaccineingredienser kan gemme sig i små molekylebibliotekerForskerne fandt et molekyle, der kan bruges som vaccineadjuvans og styrker immunresponset, når det tilsættes en vaccine. Kredit:Mindy Takamiya/Kyoto University iCeMS Mange vacciner indeholder ingr -
 Ny metode til at opdage og visualisere sædceller genvundet fra retsmedicinsk bevisKredit:CC0 Public Domain En af de mest værdifulde former for retsmedicinsk bevismateriale i tilfælde af mandlige begåede seksuelle overgreb er tilstedeværelsen af sæd, enten i form af pletter ef
Ny metode til at opdage og visualisere sædceller genvundet fra retsmedicinsk bevisKredit:CC0 Public Domain En af de mest værdifulde former for retsmedicinsk bevismateriale i tilfælde af mandlige begåede seksuelle overgreb er tilstedeværelsen af sæd, enten i form af pletter ef -
 En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore
En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore
- Forskere rapporterer om nyt termoelektrisk materiale med høje effektfaktorer
- Er det ikke et objekts bevægelse kan måles ved at se på det?
- Hvis du ville finde en prøve af fermium, som har et atomnummer 100, ville du kigge efter?
- Skrevet i blod:Hvordan blodplet 'haler' kan pege på væsentlige, yderligere retsmedicinske detaljer…
- Mand i Tyskland dræbt, da AA-batterioplader eksploderer
- Sådan fungerer atomubåde


