Hvad er molekylær geometri af CL2?
Her er hvorfor:
* Lewis -struktur: Klor har 7 valenselektroner. I CL₂ deler hvert kloratom det ene elektron med det andet, der danner en enkelt kovalent binding. Dette resulterer i, at begge kloratomer har en komplet oktet.
* VSEPR -teori: Valence Shell Electron Pair Repulsion (VSEPR) -teorien forudsiger formen af molekyler baseret på frastødning mellem elektronpar omkring det centrale atom. I CL₂ er der ingen ensomme par elektroner på hverken chloratom, kun det delte par i bindingen.
* lineær geometri: Med to atomer og ingen ensomme par er det eneste mulige arrangement en lige linje, hvilket resulterer i en lineær molekylær geometri.
 Varme artikler
Varme artikler
-
 Vedligeholdelse af veje med drue og landbrugsaffaldXianming Shi tænkte først på at bruge bioteknologi til at udlede tilsætningsstoffer til affald fra landbrugsaffaldsmaterialer for flere år siden, da Alaskas transportministerium fik til opgave at udvi
Vedligeholdelse af veje med drue og landbrugsaffaldXianming Shi tænkte først på at bruge bioteknologi til at udlede tilsætningsstoffer til affald fra landbrugsaffaldsmaterialer for flere år siden, da Alaskas transportministerium fik til opgave at udvi -
 Forskere opnår 4-D trykt materialeForskerne printede deres silikone-baserede prøver ved hjælp af en direkte blæk-skriveproces. Det sammensatte blækmateriale blev ekstruderet ved stuetemperatur fra printerens dyse for at danne træbunke
Forskere opnår 4-D trykt materialeForskerne printede deres silikone-baserede prøver ved hjælp af en direkte blæk-skriveproces. Det sammensatte blækmateriale blev ekstruderet ved stuetemperatur fra printerens dyse for at danne træbunke -
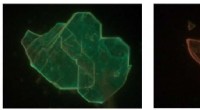 Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitterBredfeltsfotoluminescensmikrofotografier (230_175 μm) viser, hvordan nogle Perovskite-flager ser lysegrønne ud over hele deres område (venstre panel), mens andre flager udviser en tydeligt rødforskudt
Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitterBredfeltsfotoluminescensmikrofotografier (230_175 μm) viser, hvordan nogle Perovskite-flager ser lysegrønne ud over hele deres område (venstre panel), mens andre flager udviser en tydeligt rødforskudt -
 Mysteriet om, hvordan sorte enkeedderkopper skaber stålstyrke silkespind, blev yderligere optrevletLatrodectus hesperus , kendt almindeligvis som den sorte enkeedderkop i Nordamerika. Forskere ved Northwestern University og San Diego State University har afsløret den komplekse proces af, hvordan s
Mysteriet om, hvordan sorte enkeedderkopper skaber stålstyrke silkespind, blev yderligere optrevletLatrodectus hesperus , kendt almindeligvis som den sorte enkeedderkop i Nordamerika. Forskere ved Northwestern University og San Diego State University har afsløret den komplekse proces af, hvordan s


