Når 0,422 g af et fosfor brændes 0,967 hvidt oxid opnåede, hvad den empiriske formel og også afbalanceret ligning for reaktion O2 fra EF?
1. Bestem massen af ilt:
* Mass af ilt =masse af oxid - masse af fosfor
* Masse ilt =0,967 g - 0,422 g =0,545 g
2. Konverter masser til mol:
* Mol af fosfor =masse af fosfor / molmasse af fosfor
* Mol phosphor =0,422 g / 30,97 g / mol =0,0136 mol
* Mol ilt =masse ilt / molær masse ilt
* Mol ilt =0,545 g / 16,00 g / mol =0,0341 mol
3. Find molforholdet:
* Opdel antallet af mol af hvert element med det mindste antal mol:
* Fosfor:0,0136 mol / 0,0136 mol =1
* Oxygen:0,0341 mol / 0,0136 mol =2,5
4. Konverter til hele tal:
* Da vi har et forhold på 1:2,5, multiplicerer begge sider med 2 for at få hele tal:
* Fosfor:1 x 2 =2
* Oxygen:2,5 x 2 =5
5. Empirisk formel:
* Den empiriske formel for fosforoxidet er p₂o₅ .
6. Afbalanceret kemisk ligning:
* Den afbalancerede kemiske ligning til reaktion af fosfor med ilt er:
4 P + 5 O₂ → 2 P₂O₅
Forklaring:
* Den empiriske formel repræsenterer det enkleste forhold mellem hele antal atomer i en forbindelse.
* Den afbalancerede kemiske ligning sikrer, at antallet af atomer i hvert element er det samme på begge sider af ligningen efter loven om bevarelse af masse.
 Varme artikler
Varme artikler
-
 Forskere skaber kunstig brusk, der kan reparere sig selvBiopolymerkemiker Lingyun Chen arbejder i sit laboratorium i U of A. Chen og hendes team er ved at udvikle en hydrogel fremstillet af affaldsbiprodukter som krabbeskaller og træflis, der kan reparere
Forskere skaber kunstig brusk, der kan reparere sig selvBiopolymerkemiker Lingyun Chen arbejder i sit laboratorium i U of A. Chen og hendes team er ved at udvikle en hydrogel fremstillet af affaldsbiprodukter som krabbeskaller og træflis, der kan reparere -
 Mælkesyrebakterier kan forlænge fødevarers holdbarhedKredit:CC0 Public Domain Forskere ved National Food Institute, Tekniske Universitet Danmark, har genereret en mælkesyrebakterie, der effektivt udskiller et konserveringsmiddel af fødevarekvalitet,
Mælkesyrebakterier kan forlænge fødevarers holdbarhedKredit:CC0 Public Domain Forskere ved National Food Institute, Tekniske Universitet Danmark, har genereret en mælkesyrebakterie, der effektivt udskiller et konserveringsmiddel af fødevarekvalitet, -
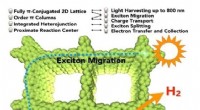 Fotokatalytisk brintproduktion fra vandIllustration af den kulstof-konjugerede kovalente organiske ramme (COF), der viser det fotokatalytiske system, hvor en lang række synligt lys kan høstes til produktion af hydrogengas fra vand. Nanopar
Fotokatalytisk brintproduktion fra vandIllustration af den kulstof-konjugerede kovalente organiske ramme (COF), der viser det fotokatalytiske system, hvor en lang række synligt lys kan høstes til produktion af hydrogengas fra vand. Nanopar -
 Vurdering af risici ved fedtafvisende kemikalier i fødevareemballage kræver nye metoder, undersøg…Kredit:Unsplash/CC0 Public Domain Udvikling af måder at måle og studere eksponeringer for en klasse af syntetiske kemikalier er afgørende for at imødegå potentielle sundhedsrisici, der stammer fra
Vurdering af risici ved fedtafvisende kemikalier i fødevareemballage kræver nye metoder, undersøg…Kredit:Unsplash/CC0 Public Domain Udvikling af måder at måle og studere eksponeringer for en klasse af syntetiske kemikalier er afgørende for at imødegå potentielle sundhedsrisici, der stammer fra


