Er en binding mellem kobber og fluorionisk binding?
* Elektronegativitetsforskel: Fluor er det mest elektronegative element, hvilket betyder, at det har en stærk attraktion for elektroner. Kobber, mens et metal, har en relativt lavere elektronegativitet. Forskellen i elektronegativitet mellem kobber og fluor er stor nok (ca. 1,9) til at skabe en betydelig overførsel af elektroner.
* Elektronoverførsel: På grund af den store elektronegativitetsforskel stjæler fluor effektivt et elektron fra kobber. Dette resulterer i, at kobber danner en positivt ladet ion (Cu+) og fluor, der danner en negativt ladet ion (F-).
* Elektrostatisk attraktion: De modsatte ladede ioner tiltrækker hinanden stærkt og danner en ionisk binding.
Derfor klassificeres bindingen mellem kobber og fluor som ionisk på grund af den betydelige elektronegativitetsforskel, der fører til elektronoverførsel og elektrostatisk attraktion.
 Varme artikler
Varme artikler
-
 Multifunktionelle drømkeramiske matrixkompositter fødes(Øverst til venstre) Dette er en struktur af Ti-spredt AI 2 O 3 kompositter (nederst til venstre) Ti -indhold afhængighed af brud ruhed og elektrisk resistivitet (midten) Nanostruktur af overflade
Multifunktionelle drømkeramiske matrixkompositter fødes(Øverst til venstre) Dette er en struktur af Ti-spredt AI 2 O 3 kompositter (nederst til venstre) Ti -indhold afhængighed af brud ruhed og elektrisk resistivitet (midten) Nanostruktur af overflade -
 Enhed på størrelse med mønt registrerer mæslingevirus i spytKredit:Unsplash/CC0 Public Domain Mæslinger er en af de mest smitsomme luftbårne vira på verdensplan. En billig og effektiv vaccine er tilgængelig, men mæslinger er almindelig i udviklingslande,
Enhed på størrelse med mønt registrerer mæslingevirus i spytKredit:Unsplash/CC0 Public Domain Mæslinger er en af de mest smitsomme luftbårne vira på verdensplan. En billig og effektiv vaccine er tilgængelig, men mæslinger er almindelig i udviklingslande, -
 Forskere giver indsigt i letvægtsmateriale, der udvider sig med varmeKredit:Chong Min Koos gruppe ved Korea Institute of Science and Technology (KIST) Når det kommer til at tage plads uden at lægge for meget vægt, boblen kan ikke slås. Fordi de for det meste er luf
Forskere giver indsigt i letvægtsmateriale, der udvider sig med varmeKredit:Chong Min Koos gruppe ved Korea Institute of Science and Technology (KIST) Når det kommer til at tage plads uden at lægge for meget vægt, boblen kan ikke slås. Fordi de for det meste er luf -
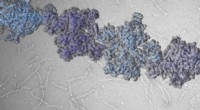 Enigma med fedtsyremetabolisme løst - enzymform styrer aktivitetenACC filamenter regulerer enzymaktivitet og kontrollerer dermed fedtsyreproduktionen. Kredit:Universitetet i Basel, Biozentrum Kernekomponenterne i alt kropsfedt er fedtsyrer. Deres produktion init
Enigma med fedtsyremetabolisme løst - enzymform styrer aktivitetenACC filamenter regulerer enzymaktivitet og kontrollerer dermed fedtsyreproduktionen. Kredit:Universitetet i Basel, Biozentrum Kernekomponenterne i alt kropsfedt er fedtsyrer. Deres produktion init
- Hvilken farve er jodid i mineralolie?
- Forskning viser, hvor meget administrerende direktører betyder noget for virksomhedens præstatione…
- Franske medier tager kampen om ophavsret til Google
- Hvordan apokalypse blev en sekulær såvel som religiøs idé
- Her er hvorfor NASA vender tilbage til Venus efter 40 år
- Hvad er et andet cellenavn for transplantatafvisningsceller?


