Hvordan er en fluorisotop forskellig fra ion, hvordan er de de samme?
fluorisotoper
* Definition: Isotoper er atomer med det samme element, der har det samme antal protoner, men forskellige antal neutroner.
* Nøglefunktion: Antallet af neutroner varierer ved at ændre atommassen.
* Eksempel: Fluor-19 (den mest almindelige isotop) har 9 protoner og 10 neutroner, mens fluor-18 har 9 protoner og 9 neutroner.
* Kemisk opførsel: Isotoper af det samme element opfører sig næsten identisk i kemiske reaktioner, fordi de har det samme antal elektroner, der dikterer kemisk binding.
fluorioner
* Definition: En ion er et atom eller molekyle, der har opnået eller mistet elektroner, hvilket resulterer i en netto elektrisk ladning.
* Nøglefunktion: Antallet af elektroner ændres, hvilket skaber en positiv eller negativ ladning.
* Eksempel: En fluorion ion (F-) har opnået en elektron, hvilket giver den en -1 -ladning.
* Kemisk opførsel: Ioner opfører sig forskelligt fra neutrale atomer på grund af deres ladning. De deltager i ionisk binding og danner forbindelser med modsat ladede ioner.
ligheder
* begge er former for fluor: Både isotoper og ioner er variationer af elementets fluor.
* begge har 9 protoner: Den grundlæggende byggesten af fluor forbliver den samme (9 protoner).
nøgleforskel
* isotoper adskiller sig i neutronantal, der påvirker masse
* ioner adskiller sig i elektronantal, der påvirker ladningen.
på enkle termer
Tænk på det sådan:
* Isotoper er som forskellige versioner af den samme bil med lidt forskellige motorer (neutronnummer) men kører på samme måde (kemisk opførsel).
* ioner er som den samme bil med forskellige modifikationer, som en spoiler eller et trækkort (elektronnummer), der ændrer, hvordan det håndterer (kemisk opførsel).
Sidste artikelHvorfor er gasformig n mindre reaktiv end gaseos f?
Næste artikelHvor mange molekyler er der i et saltkorn?
 Varme artikler
Varme artikler
-
 Belægning til metaller heler hurtigt over ridser og skrammer for at forhindre korrosionKredit:CC0 Public Domain Det er svært at tro, at en lille revne kan nedbryde en gigantisk metalkonstruktion. Men nogle gange falder broer sammen, rørledninger går i stykker og skrog løsner sig fra
Belægning til metaller heler hurtigt over ridser og skrammer for at forhindre korrosionKredit:CC0 Public Domain Det er svært at tro, at en lille revne kan nedbryde en gigantisk metalkonstruktion. Men nogle gange falder broer sammen, rørledninger går i stykker og skrog løsner sig fra -
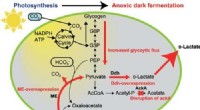 Metoden giver høj mængde af D-lactat ved hjælp af cyanobakterier, kunne revolutionere produktione…Figur 1:Vejen til omdannelse af kuldioxid til D-laktat. Synechocystis sp. PCC 6803 producerer glykogen inde i sine celler fra CO2 og lys. Det blev afsløret, at når Synechocystis sp. PCC 6803, der har
Metoden giver høj mængde af D-lactat ved hjælp af cyanobakterier, kunne revolutionere produktione…Figur 1:Vejen til omdannelse af kuldioxid til D-laktat. Synechocystis sp. PCC 6803 producerer glykogen inde i sine celler fra CO2 og lys. Det blev afsløret, at når Synechocystis sp. PCC 6803, der har -
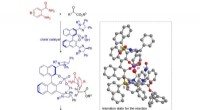 Ny metode til asymmetrisk N, N-acetalsyntese lover fremskridt inden for lægemiddeludviklingKredit:Nagoya Institute of Technology Mange af vores lægemidler og andre bioaktive lægemidler er baseret på kemiske strukturer kaldet enantiomerer - molekyler, der er spejlbilleder af hinanden og
Ny metode til asymmetrisk N, N-acetalsyntese lover fremskridt inden for lægemiddeludviklingKredit:Nagoya Institute of Technology Mange af vores lægemidler og andre bioaktive lægemidler er baseret på kemiske strukturer kaldet enantiomerer - molekyler, der er spejlbilleder af hinanden og -
 Uden for vægten:Fiskepanser både sejt og fleksibeltOptisk mikroskopibillede af tværsnittet af en karpeskala, der viser en flerlagsstruktur. Kredit:Quan et al., Struktur og mekanisk tilpasningsevne af en moderne Elasmoid fiskeskala fra almindelig karpe
Uden for vægten:Fiskepanser både sejt og fleksibeltOptisk mikroskopibillede af tværsnittet af en karpeskala, der viser en flerlagsstruktur. Kredit:Quan et al., Struktur og mekanisk tilpasningsevne af en moderne Elasmoid fiskeskala fra almindelig karpe
- Hvad er en stor cool stjerneform, når du løber tør for brint?
- Hvilken stødende sten har den samme kemiske sammensætning som basalt, men en anden kornstørrelse?…
- Hvilken overførsel af energi ved bevægelsesvæsker eller gasser med forskellige temperaturer kalde…
- Hvem er opfinderen af lysmikroskop?
- Journal udforsker database, der kvantificerer miljøpåvirkninger i en global verden
- Hvordan bruges adsorbenter til miljøoprydning?


