Hvilken påvirkning har en solid ikke -ioniserende opløst stof på det frysepunkt for opløsningsmiddel?
* Kolligative egenskaber: Disse egenskaber ved opløsninger afhænger kun af antallet af tilstedeværende opløste partikler, ikke deres identitet.
* frysningspunkt: Frysningspunktet for et opløsningsmiddel er den temperatur, hvorpå dens flydende og faste faser er i ligevægt.
* opløst interferens: Når et opløst stof opløses i et opløsningsmiddel, forstyrrer det det regelmæssige arrangement af opløsningsmiddelmolekyler. Dette gør det sværere for opløsningsmiddelmolekylerne at danne en fast gitterstruktur, hvilket kræver en lavere temperatur til frysning at forekomme.
Nøglepunkter:
* ikke -ioniserende: Opløsningen danner ikke ioner i opløsningen, hvilket betyder, at den forbliver som individuelle molekyler.
* fast: Opløsningen er et fast stof, før det opløses, men dens tilstand påvirker ikke princippet.
* Koncentration: Jo større koncentration af opløstelsen er, jo lavere er frysepunktet for opløsningen.
Eksempel:
Tilsætning af salt til vand sænker sit frysepunkt, og det er grunden til, at salt bruges til at deis veje om vinteren. Salten opløses i vandet og sænker frysepunktet under det typiske frysepunkt for vand (0 ° C).
 Varme artikler
Varme artikler
-
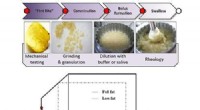 Design af en bedre fedtfattig kartoffelchipsKredit:American Chemical Society At gnaske på fedtfattige kartoffelchips kan reducere skyldfølelsen sammenlignet med fuldfedte versioner, men mange mennesker finder ikke teksturen så tiltalende. N
Design af en bedre fedtfattig kartoffelchipsKredit:American Chemical Society At gnaske på fedtfattige kartoffelchips kan reducere skyldfølelsen sammenlignet med fuldfedte versioner, men mange mennesker finder ikke teksturen så tiltalende. N -
 Syntetisere en ny klasse af bio-inspirerede, lysfangende nanomaterialerPOSS-peptoidmolekyler samler sig selv til rombeformede nanokrystaller. Kredit:Stephanie King | Pacific Northwest National Laboratory Inspireret af naturen, forskere ved Pacific Northwest National
Syntetisere en ny klasse af bio-inspirerede, lysfangende nanomaterialerPOSS-peptoidmolekyler samler sig selv til rombeformede nanokrystaller. Kredit:Stephanie King | Pacific Northwest National Laboratory Inspireret af naturen, forskere ved Pacific Northwest National -
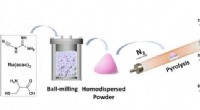 Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite
Nye enkelt-atom katalyse støvler reduktiv amineringsreaktionSkematisk illustration til fremstilling af Ru1/NC-T katalysatorer. Kredit:DICP Den geometriske isolering af metalarter i single-atom catalyse (SACer) maksimerer ikke kun atomudnyttelseseffektivite -
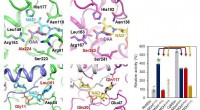 Forskere præsenterer en mikrobiel stamme, der er i stand til massiv ravsyreproduktionProteinudvikling af nøgleenzymer svarende til produktion af ravsyre. Kredit:KAIST Et forskerhold ledet af den fremtrædende professor Sang-Yup Lee rapporterede produktionen af en mikrobiel stamme
Forskere præsenterer en mikrobiel stamme, der er i stand til massiv ravsyreproduktionProteinudvikling af nøgleenzymer svarende til produktion af ravsyre. Kredit:KAIST Et forskerhold ledet af den fremtrædende professor Sang-Yup Lee rapporterede produktionen af en mikrobiel stamme
- Den store syndflod:mere end en myte?
- Nyt værktøj forudsiger risiko for plantesygdom og angreb verden over
- Forklar hvad en kemisk ændring er?
- NASAs Ingenuity Mars Helicopter optager video af rekordflyvning
- Hvorfor forseglede russerne det dybeste hul i verden?
- Hvad bruger en læge til at måle den gennemsnitlige kinetiske energi af molekyler i din krop?


