Hvilke af disse grunde forklarer, hvorfor ikke -metalliske elementer har lave smeltepunkter?
* binding: Ikke -metaller former primært kovalente obligationer . Kovalente obligationer involverer deling af elektroner mellem atomer, hvilket skaber stærke bindinger, der kræver en masse energi for at bryde. Dette fører til højere smeltepunkter.
* Intermolekylære kræfter: Mens kovalente bindinger er stærke inden for molekyler, kan kræfterne mellem molekyler (intermolekylære kræfter) i ikke -metaller variere. Nogle ikke -metaller udviser stærke intermolekylære kræfter som hydrogenbinding, som bidrager til højere smeltepunkter.
Eksempler:
* diamant: Et af de hårdest kendte stoffer er en ikke -metal med et ekstremt højt smeltepunkt (3550 ° C).
* silicium: En anden ikke -metal med et højt smeltepunkt (1414 ° C).
* jod: Et ikke -metal med et relativt lavt smeltepunkt (113 ° C), men dette er stadig markant højere end mange metaller.
Metaller har på den anden side lave smeltepunkter på grund af:
* Metallisk binding: Metaller har et "hav" af delokaliserede elektroner, der skaber svage bindinger mellem metalatomer. Dette gør det muligt for atomerne at glide forbi hinanden relativt let, hvilket resulterer i lavere smeltepunkter.
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelHvilke to elementer er i natriumchlorid?
Næste artikelHvad er fordele og ulemper ved jernholdige metaller?
 Varme artikler
Varme artikler
-
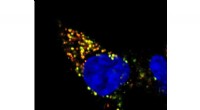 Sortering og udskillelse af insulin efter udløbsdatoForskere tog dette billede af en insulin-udskillende celle fra en mus ved hjælp af en teknik til at mærke insulin granulat, efter alder. I yngre granulater, markøren udsender et grønt fluorescerende l
Sortering og udskillelse af insulin efter udløbsdatoForskere tog dette billede af en insulin-udskillende celle fra en mus ved hjælp af en teknik til at mærke insulin granulat, efter alder. I yngre granulater, markøren udsender et grønt fluorescerende l -
 Discovery booster teorien om, at liv på Jorden opstod fra RNA-DNA-blandingKredit:CC0 Public Domain Kemikere ved Scripps Research har gjort en opdagelse, der understøtter et overraskende nyt syn på, hvordan liv opstod på vores planet. I en undersøgelse offentliggjort i
Discovery booster teorien om, at liv på Jorden opstod fra RNA-DNA-blandingKredit:CC0 Public Domain Kemikere ved Scripps Research har gjort en opdagelse, der understøtter et overraskende nyt syn på, hvordan liv opstod på vores planet. I en undersøgelse offentliggjort i -
 Forskere udvikler en effektiv, lavenergimetode til upcycling af polyethylenplastaffald til værdiful…Kredit:Pixabay/CC0 Public Domain Da vi begyndte at bruge plast for omkring 70 år siden, Der blev ikke tænkt så meget over – om nogen – hvad konsekvenserne af deres levetid havde og det faktum, at
Forskere udvikler en effektiv, lavenergimetode til upcycling af polyethylenplastaffald til værdiful…Kredit:Pixabay/CC0 Public Domain Da vi begyndte at bruge plast for omkring 70 år siden, Der blev ikke tænkt så meget over – om nogen – hvad konsekvenserne af deres levetid havde og det faktum, at -
 Forskere udvikler ny røntgendetekteringsteknologiEn forsker har en fleksibel røntgenscintillator udviklet af professor Biwu Ma og hans forskerhold. Teamet har udviklet et nyt materiale, der kan bruges til at lave fleksible røntgendetektorer, der er
Forskere udvikler ny røntgendetekteringsteknologiEn forsker har en fleksibel røntgenscintillator udviklet af professor Biwu Ma og hans forskerhold. Teamet har udviklet et nyt materiale, der kan bruges til at lave fleksible røntgendetektorer, der er
- Opdræt af tropisk fiske skal forbedres som følge af nyt samarbejde
- Fra skovbrandene til coronavirus, vores gamle normal er væk for altid
- Vand til en overkommelig pris i USA:En spirende krise
- De fem største opdagelser foretaget af Radio Telescopes
- Den ydre galakse
- Kosmisk linse afslører svag radiogalakse


