Er OCL2 en molekylær eller ionisk binding?
* Elektronegativitetsforskel: Oxygen er mere elektronegativ end klor. Selvom der er forskel i elektronegativitet, er den ikke stor nok til at danne ioniske bindinger. Forskellen i elektronegativitet fører til polære kovalente bindinger .
* Delte elektroner: Oxygen- og klorelektroner til dannelse af kovalente bindinger. Denne deling resulterer i dannelsen af et molekyle.
* samlet afgift: OCL2 er et neutralt molekyle. Der er ingen netto positiv eller negativ opladning. Ioniske forbindelser har derimod en kation (positiv ion) og en anion (negativ ion).
Kortfattet: OCL2 danner en molekylær struktur på grund af deling af elektroner mellem ilt- og kloratomer gennem polære kovalente bindinger.
 Varme artikler
Varme artikler
-
 Bedre forståelse af naturens nanomaskiner kan hjælpe med design af fremtidige lægemidlerMartin Schmeing, Lektor ved Institut for Biokemi ved McGill University og hans team har fået en bedre forståelse af, hvordan naturens nanomaskiner fungerer. Det er information, der kan hjælpe med desi
Bedre forståelse af naturens nanomaskiner kan hjælpe med design af fremtidige lægemidlerMartin Schmeing, Lektor ved Institut for Biokemi ved McGill University og hans team har fået en bedre forståelse af, hvordan naturens nanomaskiner fungerer. Det er information, der kan hjælpe med desi -
 Frysning af celler gjort sikrere takket være ny polymerCellerne frosset med polymeren (venstre) og uden polymeren (højre). Kredit:University of Warwick Cellefrysning (cryopreservation) - hvilket er essentielt i celletransfusioner såvel som grundlæggen
Frysning af celler gjort sikrere takket være ny polymerCellerne frosset med polymeren (venstre) og uden polymeren (højre). Kredit:University of Warwick Cellefrysning (cryopreservation) - hvilket er essentielt i celletransfusioner såvel som grundlæggen -
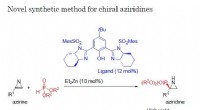 Ny kemisk syntesemetode kan producere en spændende række nye forbindelserForskere ved Nagoya Institute of Technology har etableret en reaktion katalyseret af Bis(imidazolin)/zink, hvorved 2H-aziriner reagerer med phosphit, hvilket giver aziridiner ved et højt enantiomert f
Ny kemisk syntesemetode kan producere en spændende række nye forbindelserForskere ved Nagoya Institute of Technology har etableret en reaktion katalyseret af Bis(imidazolin)/zink, hvorved 2H-aziriner reagerer med phosphit, hvilket giver aziridiner ved et højt enantiomert f -
 Risforskere forenkler inkorporeringen af nitrogen i molekylerRice Universitets elektrofile amineringsmidler muliggør hurtig dannelse af carbon-nitrogenbindinger, der er kernen i en lang række kemiske forbindelser, herunder størstedelen af lægemiddelkandidater
Risforskere forenkler inkorporeringen af nitrogen i molekylerRice Universitets elektrofile amineringsmidler muliggør hurtig dannelse af carbon-nitrogenbindinger, der er kernen i en lang række kemiske forbindelser, herunder størstedelen af lægemiddelkandidater
- Hvad betyder kanal din energi?
- Bleriot XI
- Hvad er en hvid dværg, der er stoppet med at udstråle energi?
- Hvilken slags klippe dannes ved at forvitre erosionsaflejring?
- Hvad er formlen til at bestemme accelerationen af et objekt, der bevæger sig i en stræder?
- Det mest spektakulære himmelsyn, du aldrig vil se


