Hvorfor elektrovalente forbindelser udfører elektricitet?
* solid tilstand: I fast tilstand findes ioniske forbindelser som en stiv gitterstruktur. Ionerne holdes tæt i faste positioner af stærke elektrostatiske kræfter. Dette betyder, at der ikke er nogen fri bevægelsesladningsbærere (ioner) til at bære en elektrisk strøm.
* opløst eller smeltet tilstand: Når den er opløst i vand eller smeltet, bryder den ioniske gitter. Ionerne bliver frie til at bevæge sig rundt.
* opløste: Vandmolekyler omgiver ionerne og trækker dem fra hinanden og forstyrrer krystalgitteret. Ionerne er nu frie til at bevæge sig uafhængigt i opløsningen.
* smeltning: Varmeenergien overvinder de elektrostatiske kræfter, der holder ionerne sammen i gitteret, så de kan bevæge sig frit.
* ledning: Når et elektrisk potentiale påføres på tværs af opløsningen eller den smeltede ioniske forbindelse, bevæger de frie ioner sig mod den modsatte ladede elektrode. Denne bevægelse af ladede partikler udgør en elektrisk strøm.
Kortfattet: Elektrovalente forbindelser udfører elektricitet, fordi de indeholder frie ioner, der kan bære den elektriske strøm. Disse frie ioner er kun tilgængelige, når forbindelsen opløses i vand eller smeltes, hvilket gør det muligt for ionerne at bevæge sig frit.
Sidste artikelHvad er den kemiske reaktion, når syre tilsættes til klor?
Næste artikelHvad er formlen for lithiumacetat?
 Varme artikler
Varme artikler
-
 DNA-baseret metode detekterer spormængder af jordnødder i fødevarerKredit:American Chemical Society For personer med svær jordnøddeallergi, at spise selv små mængder af bælgfrugten kan udløse anafylaksi - en livstruende tilstand karakteriseret ved svimmelhed, vej
DNA-baseret metode detekterer spormængder af jordnødder i fødevarerKredit:American Chemical Society For personer med svær jordnøddeallergi, at spise selv små mængder af bælgfrugten kan udløse anafylaksi - en livstruende tilstand karakteriseret ved svimmelhed, vej -
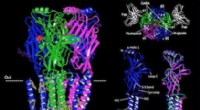 Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løstArkitekturen af GABAA-receptoren. Kredit:UT Southwestern UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges t
Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løstArkitekturen af GABAA-receptoren. Kredit:UT Southwestern UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges t -
 Nyt materiale kan generere brint fra salt og forurenet vandKredit:Tomsk Polytechnic University Forskere ved Tomsk Polytechnic University sammen med teams fra University of Chemistry and Technology, Prag og Jan Evangelista Purkyne Universitet i Ústí nad La
Nyt materiale kan generere brint fra salt og forurenet vandKredit:Tomsk Polytechnic University Forskere ved Tomsk Polytechnic University sammen med teams fra University of Chemistry and Technology, Prag og Jan Evangelista Purkyne Universitet i Ústí nad La -
 High-throughput metode til at identificere nye materialerIllustrative eksempler og resumé af optisk kortlægning af tre-kation-oxider. Sammensætningskortene for absorptionskoefficienten (α) ved 3,2 eV og 1,5 eV samt resultaterne af den emergent egenskabsmode
High-throughput metode til at identificere nye materialerIllustrative eksempler og resumé af optisk kortlægning af tre-kation-oxider. Sammensætningskortene for absorptionskoefficienten (α) ved 3,2 eV og 1,5 eV samt resultaterne af den emergent egenskabsmode
- Popbobler:Overfladeaktive stoffer har en overraskende effekt på nanobobble -stabiliteten
- Kunne massive gravitioner være levedygtige kandidater til mørkt stof?
- Hvordan kan du opdage en lille lækage af gasformigt klor i omkring en kloreringsmaskine?
- Giftig maskulinitet:hvad betyder det, hvor kom det fra - og er udtrykket nyttigt eller skadeligt?
- Hvad er en enorm samling af stjerner?
- Hvor rigeligt er svovl i skorpen?


