Hvor er dipolen i nitrogen-hydrogenbindingspunkt?
* Elektronegativitet: Nitrogen er mere elektronegativ end brint. Dette betyder, at nitrogen har et stærkere træk på de delte elektroner i bindingen.
* Elektrondensitet: Som et resultat tilbringer de delte elektroner mere tid tættere på nitrogenatomet, hvilket skaber en delvis negativ ladning (Δ-) på nitrogenet og en delvis positiv ladning (Δ+) på brint.
* dipolmoment: Denne forskel i ladning skaber et dipolmoment, som er en vektor, der peger fra det positive til den negative ende.
Derfor peger dipolmomentet i en N-H-binding mod nitrogenatomet.
 Varme artikler
Varme artikler
-
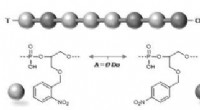 Hemmelige beskeder gemt i lysfølsomme polymererSkematisk fremstilling af et hemmeligt molekylært budskab afsløret af lys. Kredit:© Jean-François Lutz Forskere fra CNRS og Aix-Marseille Université har for nylig vist, hvor værdifulde lysfølsomme
Hemmelige beskeder gemt i lysfølsomme polymererSkematisk fremstilling af et hemmeligt molekylært budskab afsløret af lys. Kredit:© Jean-François Lutz Forskere fra CNRS og Aix-Marseille Université har for nylig vist, hvor værdifulde lysfølsomme -
 Websted for datadeling kan fremskynde reaktionen på nye ulovlige stofferNPS DataHub giver retsmedicinske kemikere mulighed for at dele data om nye lægemiddelanaloger, herunder deres kemiske strukturer og signaturer, som er nøglerne til at identificere dem i laboratoriet.
Websted for datadeling kan fremskynde reaktionen på nye ulovlige stofferNPS DataHub giver retsmedicinske kemikere mulighed for at dele data om nye lægemiddelanaloger, herunder deres kemiske strukturer og signaturer, som er nøglerne til at identificere dem i laboratoriet. -
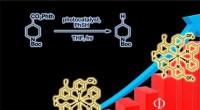 Inspireret af fotosyntese, forskere dobbeltreaktion kvanteeffektivitetReaktionens kvanteudbytte, sådan måler forskere effektiviteten af en lysaktiveret reaktion. Kredit:Anna Zieleniewska. Ud fra inspiration fra fotosyntese og den måde, hvorpå den kan opnå høj effe
Inspireret af fotosyntese, forskere dobbeltreaktion kvanteeffektivitetReaktionens kvanteudbytte, sådan måler forskere effektiviteten af en lysaktiveret reaktion. Kredit:Anna Zieleniewska. Ud fra inspiration fra fotosyntese og den måde, hvorpå den kan opnå høj effe -
 Kemisk innovation stabiliserer den bedst ydende perovskit-formuleringUdgiver i Videnskab , forskere ved EPFL har med succes overvundet et begrænsende problem med at stabilisere den bedst ydende formulering af metalhalogenid perovskitfilm, en nøglespiller i en række a
Kemisk innovation stabiliserer den bedst ydende perovskit-formuleringUdgiver i Videnskab , forskere ved EPFL har med succes overvundet et begrænsende problem med at stabilisere den bedst ydende formulering af metalhalogenid perovskitfilm, en nøglespiller i en række a
- Har Neutron Star en begivenhedshorisont?
- Kan en drone afsløre de skumle hemmeligheder i San Francisco Bay?
- Forskere opdager de første røntgenstråler fra mystiske supernovaer
- Blinker planeter på nattehimlen?
- Månens tidevandsspænding er sandsynligvis ansvarlig for at forårsage dybe måneskælv, ny undersø…
- Forskning foreslår et virtuelt fartbump for lynhurtige markeder


