Kobbertråd sættes i en opløsning af sølvnitrat. Krystaller dannes. Hvorfor viser Go Blue, og hvordan viser du den redoxreaktion?
reaktionen
Når kobbertråd anbringes i en sølvnitratopløsning, forekommer en enkelt forskydningsreaktion. Kobber er mere reaktiv end sølv, så det fortrænger sølv fra dets nitratforbindelse. Dette er hvad der sker:
* kobber (Cu) reagerer med sølvnitrat (Agno₃) for at danne kobber (II) nitrat (Cu (no₃) ₂) og sølv (Ag).
Den kemiske ligning for denne reaktion er:
cu (s) + 2agno₃ (aq) → cu (no₃) ₂ (aq) + 2ag (s)
Hvorfor løsningen bliver blå
Opløsningen bliver blå på grund af dannelsen af kobber (II) nitrat (Cu (no₃) ₂). Kobber (II) ioner (Cu²⁺) i opløsning er blå. Denne farveændring er en visuel indikation af, at reaktionen finder sted.
viser, at det er en redox -reaktion
En redoxreaktion involverer overførsel af elektroner. For at vise dette kan vi opdele reaktionen i to halvreaktioner:
* Oxidation Halvreaktion: Kobber mister elektroner og oxideres.
* cu (s) → cu²⁺ (aq) + 2e⁻
* reduktion halvreaktion: Sølvioner får elektroner og reduceres.
* AG⁺ (aq) + e⁻ → AG (s)
Forklaring af halvreaktionerne:
* Oxidation: Kobberatomer mister to elektroner for at blive kobber (II) -ioner. Dette er en oxidation, fordi kobberatomet mister elektroner.
* reduktion: Sølvioner får en elektron hver til at blive sølvatomer. Dette er en reduktion, fordi sølvionerne får elektroner.
Nøglepunkter:
* redox: Den samlede reaktion er en redoxreaktion, fordi der er en overførsel af elektroner fra kobber til sølvioner.
* Oxidationstilstand: Oxidationstilstanden for kobber ændrer sig fra 0 til +2, og oxidationstilstanden for sølv ændres fra +1 til 0.
Visualisering af reaktionen:
Forestil dig kobbertråd nedsænket i sølvnitratopløsningen. Over tid kan du se:
* Sølvnitratopløsningen bliver blå på grund af dannelsen af kobber (II) nitrat.
* En sølvfarvet aflejring dannes på kobbertråden, når sølvatomer fortrænger sølvioner fra opløsningen.
Sidste artikelHvad er molekylær form af C2H5CL?
Næste artikelHvor er dipolen i nitrogen-hydrogenbindingspunkt?
 Varme artikler
Varme artikler
-
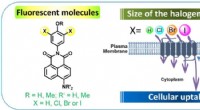 Boost bevægelsen af fluorescerende prober over cellemembranenKredit:H. Ungati et al. I årtier, Forskere har brugt fluorescerende sonder til at detektere molekyler, overvåge cellulær aktivitet og levere lægemidler inde i celler. Prober baseret på en forbinde
Boost bevægelsen af fluorescerende prober over cellemembranenKredit:H. Ungati et al. I årtier, Forskere har brugt fluorescerende sonder til at detektere molekyler, overvåge cellulær aktivitet og levere lægemidler inde i celler. Prober baseret på en forbinde -
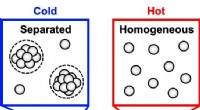 Ny model beskriver faseseparation, der ødelægger antistofopløsningerEn ny undersøgelse brugte en temperaturgradient til at observere, hvor stærkt koncentrerede antistofopløsninger, som dem, der er almindelige i nogle lægemidler, opdelt i faser, som en olie- og vandopl
Ny model beskriver faseseparation, der ødelægger antistofopløsningerEn ny undersøgelse brugte en temperaturgradient til at observere, hvor stærkt koncentrerede antistofopløsninger, som dem, der er almindelige i nogle lægemidler, opdelt i faser, som en olie- og vandopl -
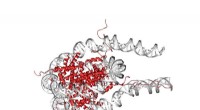 Bøjning af DNA koster mindre energi end antagetKredit:Leiden Institut for Fysik Måden DNA folder i høj grad bestemmer, hvilke gener der udlæses. John van Noort og hans gruppe har kvantificeret, hvor let sammenrullede DNA-dele stables. Dette ko
Bøjning af DNA koster mindre energi end antagetKredit:Leiden Institut for Fysik Måden DNA folder i høj grad bestemmer, hvilke gener der udlæses. John van Noort og hans gruppe har kvantificeret, hvor let sammenrullede DNA-dele stables. Dette ko -
 En bærbar måleenhed til at registrere optimal modenhed i tomaterJosu Trebolazabala analyserer sammensætningen af en tomat ved hjælp af et Raman-spektrometer. Kredit:Txetxu Berruezo Et bærbart Raman-spektrometer, en enhed, der bruges inden for meget forskelli
En bærbar måleenhed til at registrere optimal modenhed i tomaterJosu Trebolazabala analyserer sammensætningen af en tomat ved hjælp af et Raman-spektrometer. Kredit:Txetxu Berruezo Et bærbart Raman-spektrometer, en enhed, der bruges inden for meget forskelli
- Hvilket kemikalie lever?
- Tornado lab-on-a-chip teknologi med mikropincet til at opdage farlige vira, biologiske forureninger
- Hvordan ville man konvertere Newton Second Law f er lig med MA fra metrisk?
- Hvad er et pigenavn, som atmosfæren set fra Jorden?
- Storstilet undersøgelse viser ny, rigelige nitrogenfikserende mikrober i overfladehav
- Hvorfor er en tom shampooflaske så let at vælte?


