Hvilket element vil have en ædelgaskonfiguration, hvis det danner en ionisk binding ved at acceptere et elektron fra natriumatom?
Her er hvorfor:
* natrium (NA) Har en valenselektron. Når den mister denne elektron, danner den en +1 -kation (Na +) og opnår elektronkonfigurationen af neon (NE), en ædel gas.
* klor (Cl) Har syv valenselektroner. Når det får en elektron, danner det en -1 anion (Cl-) og opnår elektronkonfigurationen af argon (AR), en ædel gas.
Når natrium- og klorreaktioner, mister natrium derfor et elektron til klor, hvilket resulterer i dannelse af natriumchlorid (NaCI). Begge ioner opnår en stabil ædelgaskonfiguration, hvilket gør den ioniske binding meget stærk.
Sidste artikelHvor mange atomer af natrium kombineres med et atomchlor?
Næste artikelKan natriumhydroxid opløses i vand?
 Varme artikler
Varme artikler
-
 Flertrins deformationsproces i højentropi-legeringer ved ultralave temperaturer afsløretDeformationsvej for CrMnFeCoNi HEA-prøve ved 15 K. Lodrette stiplede linjer er tegnet for at udpege ændringerne i deformationsadfærden:(1) Start af dislokationsglidning; (2) start af stablingsfejl; (3
Flertrins deformationsproces i højentropi-legeringer ved ultralave temperaturer afsløretDeformationsvej for CrMnFeCoNi HEA-prøve ved 15 K. Lodrette stiplede linjer er tegnet for at udpege ændringerne i deformationsadfærden:(1) Start af dislokationsglidning; (2) start af stablingsfejl; (3 -
 Nyudviklet COVID-19-test registrerer og identificerer specifikke varianter med 100 % nøjagtighedKredit:Unsplash/CC0 Public Domain University of California, Irvine forskere har udviklet en COVID-19-test, der detekterer og identificerer specifikke SARS-CoV-2-varianter med 100 % nøjagtighed. I e
Nyudviklet COVID-19-test registrerer og identificerer specifikke varianter med 100 % nøjagtighedKredit:Unsplash/CC0 Public Domain University of California, Irvine forskere har udviklet en COVID-19-test, der detekterer og identificerer specifikke SARS-CoV-2-varianter med 100 % nøjagtighed. I e -
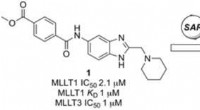 Opdagelse af selektive kemiske prober, der hæmmer epigenetiske faktorer for akut myeloid leukæmiKredit:Wiley Nogle alvorlige former for leukæmi udvikler sig, fordi proteiner på det epigenetiske niveau mister deres regulerende funktion. Nu, i et bredt internationalt samarbejde, Britiske forsk
Opdagelse af selektive kemiske prober, der hæmmer epigenetiske faktorer for akut myeloid leukæmiKredit:Wiley Nogle alvorlige former for leukæmi udvikler sig, fordi proteiner på det epigenetiske niveau mister deres regulerende funktion. Nu, i et bredt internationalt samarbejde, Britiske forsk -
 Fysikere forklarer, hvordan store sfæriske vira dannesSiyu Li (til venstre) er kandidatstuderende i laboratoriet hos Roya Zandi, en professor i fysik ved UC Riverside. De ses her holde forskellige icosahedral strukturer. Kredit:I. Pittalwala, UC Riversid
Fysikere forklarer, hvordan store sfæriske vira dannesSiyu Li (til venstre) er kandidatstuderende i laboratoriet hos Roya Zandi, en professor i fysik ved UC Riverside. De ses her holde forskellige icosahedral strukturer. Kredit:I. Pittalwala, UC Riversid
- Overraskende fakta og overbevisninger om formørkelser fra middelalderen og renæssancen
- Tarmmikrobiomer hjælper bjørne med meget forskellige diæter med at nå samme størrelse
- Hvad får slim til at vokse i mørk videnskabelig forklaring?
- Netflix CFO forlader TV-streaming-titan
- Sådan fungerer isbjerge
- Selvsamlede nanostrukturer ramte deres mål


