Hvad ville der ske med et system i ligevægt, hvis der blev tilføjet mere af en forbindelse som reaktion?
le Chateliers princip
Denne situation styres af Le Chateliers princip. Den siger, at hvis en ændring af betingelsen påføres et system i ligevægt, vil systemet skifte i en retning, der lindrer stresset. I dette tilfælde er det at tilføje flere af et reaktant eller et produkt.
skiftende ligevægt
* Tilføjelse af mere reaktant: Ligevægten skifter til højre , der favoriserer fremadrettet reaktion At forbruge den tilsatte reaktant og producere flere produkter.
* Tilføjelse af mere produkt: Ligevægten skifter til venstre , der favoriserer omvendt reaktion At forbruge det tilsatte produkt og producere flere reaktanter.
Vigtige noter:
* ligevægtskonstanten (K) forbliver den samme: Ligevægtskonstanten, der udtrykker forholdet mellem produkter og reaktanter i ligevægt, ændrer ikke, når du tilføjer mere af en forbindelse. Systemet skifter simpelthen for at opretholde det specifikke forhold.
* Omfanget af skiftet afhænger af reaktionen: Nogle reaktioner er mere følsomme over for ændringer i koncentration end andre. Størrelsen af skiftet afhænger af ligevægtskonstanten (K) og de relative mængder reaktanter og produkter, der er til stede.
eksempel
Overvej følgende reversible reaktion:
`` `
N2 (g) + 3H2 (g) ⇌ 2NH3 (g)
`` `
Hvis vi tilføjer mere nitrogen (N2) til dette system ved ligevægt, skifter ligevægten til højre, hvilket favoriserer dannelsen af ammoniak (NH3).
resume
Tilføjelse af mere af en forbindelse til et system i ligevægt vil få systemet til at skifte i en retning, der lindrer stresset. Dette betyder, at reaktionen vil favorisere produktionen af flere produkter, hvis der tilsættes en reaktant, eller produktionen af flere reaktanter, hvis der tilføjes et produkt.
 Varme artikler
Varme artikler
-
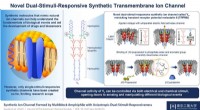 Dobbelt glæde:Ny syntetisk transmembran ionkanal kan aktiveres på to måderEn multiblok amfifil VF blev udviklet. Når VF blev inkorporeret i lipid-dobbeltlagsmembranerne, VF dannede en supramolekylær ionkanal. VFs iontransportegenskab kunne ændres reversibelt ved tilsætning
Dobbelt glæde:Ny syntetisk transmembran ionkanal kan aktiveres på to måderEn multiblok amfifil VF blev udviklet. Når VF blev inkorporeret i lipid-dobbeltlagsmembranerne, VF dannede en supramolekylær ionkanal. VFs iontransportegenskab kunne ændres reversibelt ved tilsætning -
 CRISPR-metode til betinget genreguleringWilfred Chen (til venstre), University of Delaware Gore professor i kemiteknik, og kandidatstuderende Ka-Hei Siu designede strukturer til målrettet genregulering i E. coli-bakterier. Kredit:University
CRISPR-metode til betinget genreguleringWilfred Chen (til venstre), University of Delaware Gore professor i kemiteknik, og kandidatstuderende Ka-Hei Siu designede strukturer til målrettet genregulering i E. coli-bakterier. Kredit:University -
 DESYs røntgenkilde PETRA III afslører detaljer om klæbende strukturer af edderkoppebenFor at finde ud af, hvorfor jagtedderkoppen Cupiennius salei klæber så godt til lodrette overflader, det tværfaglige forskerhold undersøger de små klæbende hår på edderkoppebenene. Kredit:Universität
DESYs røntgenkilde PETRA III afslører detaljer om klæbende strukturer af edderkoppebenFor at finde ud af, hvorfor jagtedderkoppen Cupiennius salei klæber så godt til lodrette overflader, det tværfaglige forskerhold undersøger de små klæbende hår på edderkoppebenene. Kredit:Universität -
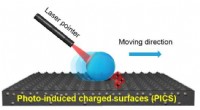 Nyt smart materiale muliggør højtydende og pålidelig lysstyring af dråberSkematiske illustrationer af lysstyring af dråber. Kredit:DU Xuemin Evnen til at manipulere dråber spiller en afgørende rolle i grundforskning og praktiske anvendelser fra kemiske reaktioner til bi
Nyt smart materiale muliggør højtydende og pålidelig lysstyring af dråberSkematiske illustrationer af lysstyring af dråber. Kredit:DU Xuemin Evnen til at manipulere dråber spiller en afgørende rolle i grundforskning og praktiske anvendelser fra kemiske reaktioner til bi
- Study bruger computervisionsalgoritme til at studere Google Street View-billeder for tegn på byænd…
- Hvilke engel skal solcellepaneler være på?
- Proces til fremstilling af plastflasker
- Forskere laver en fotografisk film af en molekylær switch
- Kunne grafen erstatte halvledere?
- Hvorfor kører kraftværker på fossilt brændstof?


