Dobbelt glæde:Ny syntetisk transmembran ionkanal kan aktiveres på to måder
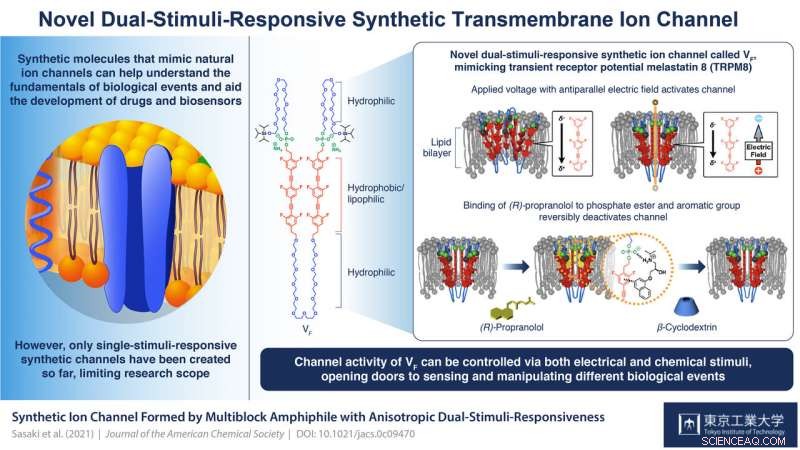
En multiblok amfifil VF blev udviklet. Når VF blev inkorporeret i lipid-dobbeltlagsmembranerne, VF dannede en supramolekylær ionkanal. VF's iontransportegenskab kunne ændres reversibelt ved tilsætning af (R)-propranolol, en aromatisk amin kendt som et antiarytmisk middel, efterfulgt af tilsætning af β-cyclodextrin til dets fjernelse. Kredit:Tokyo Tech
Forskere ved Tokyo Institute of Technology (Tokyo Tech) og University of Tokyo, Japan, har, for første gang, syntetiserede en ny kunstig transmembran ionkanal modelleret på en naturligt fundet transmembrankanal involveret i neuronsignalering - der reagerer på både kemiske og elektriske stimuli. På grund af dets generelle egenskaber, denne kunstige kanal åbner døre til ny fundamental forskning i cellulær transport og signalering, nye muligheder inden for lægemiddeludvikling, og potentialet for nye typer biosensorer.
En nøgletråd, der holder sammen den delikate balance i et komplekst biologisk system, er den transmembrane ionkanal. Disse er supramolekylære, eller multimolekyle, ion- og molekylebytterruter indlejret i cellemembraner for at sikre essentiel kemisk transport til og fra cellen og lette cellesignalering.
I de seneste år, syntetiske biomolekyler, der efterligner strukturerne og funktionerne af naturlige ionkanaler, har vakt stor interesse blandt molekylærbiologiske forskere som modeller til at studere det grundlæggende i disse kanaler og måske, selv at skabe lægemiddelalternativer eller udvikle avancerede biosensorer.
Imidlertid, selvom der er udviklet flere gode syntetiske ionkanaler, de fleste af dem aktiveres kun via en enkelt stimulus, og ingen er, hvad videnskabsmænd kalder "anisotropisk dobbelt-stimuli-responsive, " eller dem, der kan aktiveres og kontrolleres af to specifikke slags stimuli afhængigt af den skæve orientering af strukturen inde i membranen. Dette har begrænset forskningsomfang på området.
Nu, endelig, en gruppe videnskabsmænd fra Tokyo Tech og University of Tokyo, Japan, har med succes syntetiseret et biomolekyle, der ligner en naturlig anisotropisk dobbelt-stimuli-responsiv kanal:transient receptor potential melastatin 8 (TRPM8), som ligger til grund for signaltransmissioner i neuroner. Deres kanal hedder VF og deres gennembrud udgives i Journal of the American Chemical Society .
VF er et multiblok amfifilt (det har både vandelskende (hydrofile) og fedtelskende (lipofile) egenskaber) molekyle, der kan samles og danne supramolekylære kanaler. Hver enhed i en blok omfatter en organisk lipofil/hydrofob del med seks fluoridatomer, der placerer den i cellemembranens lipiddobbeltlag og giver den en elektrisk polaritet; en fosfatestergruppe, som sikrer, at strukturen er forspændt i sin orientering (med fosfatsiden mod det ekstracellulære rum); og fleksible ethylenglycol hydrofile kæder mellem hydrofobe enheder og på enderne, der bidrager til stimuli-responsiviteten.
Forskernes undersøgelser af denne struktur viste, at ved at manipulere polariteterne og amplituderne af påførte spændinger, kanalen kunne aktiveres. Prof. Kazushi Kinbara, ledende videnskabsmand i teamet, forklarer:"Uden påføring af en spænding, de hydrofobe enheder af VF frastøder hinanden, så de ville være rumligt adskilt fra hinanden og ikke ville danne klare og funktionelle transmembrane ionkanaler. Når en spænding med den elektriske feltvektor antiparallel med den elektriske polaritet af VF påføres, der forekommer en forskydning af elektronfordelingen i VF, svække frastødningen mellem hydrofobe enheder og forbedre deres ansigt til ansigt stabling. Dette forårsager konformationelle ændringer i hele molekylet, hvilket fører til dannelsen af supramolekylære kanaler, der effektivt kan transportere ioner over membranen."
Forskerne fandt ud af, at den anden stimulus havde at gøre med bindingen af ligand (R)-propranolol ved forbindelsen mellem fosfatesterne og de hydrofobe enheder. Som prof. Kinbara forklarer, "(R)-propranolol er et antiarytmisk middel, der er kendt for at blokere spændingsstyrede natriumkanaler. Desuden, vores tidligere undersøgelser indikerede, at det interagerer med fosfatestergrupper og aromatiske enheder for at lokalisere inde i kanalens pore og blokere iontransport. Det er derfor, vi valgte det til vores undersøgelse." Deres kernemagnetiske resonansspektroskopi afslørede dets binding til fosfatstederne, og at det fuldstændig hæmmer strømstrømmen og dermed ionkanalaktiviteten af VF. Dens fjernelse via tilsætning af β-cyclodextrin reaktiverer kanalen. "Reversibel ligandbinding som denne er nøglen til at opretholde homeostase i kroppen via reguleringen af transmembrane ionkanaler. Den stærkt regulerede orientering af VF muliggjorde denne anisotrope respons på dette ligandmolekyle, " Prof. Kinbara siger. "Med vores succes i denne undersøgelse, der er nu et stort potentiale for at fornemme og manipulere forskellige biologisk vigtige begivenheder."
Ja, med syntesen af VF, velegnet til de variable cellulære miljøer, der er allestedsnærværende i biologiske systemer, måske, nye muligheder for forskning opstår inden for molekylærbiologi.
 Varme artikler
Varme artikler
-
 Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National
Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National -
 Livsmæssigt rigt mønster:Forskere bruger lyd til at forme fremtidens udskrivningUtrasound og computeralgoritmer styrer, hvordan materiale sætter sig i form. Kredit:University of Bath Forskere i Storbritannien har udviklet en måde at lokke mikroskopiske partikler og dråber til
Livsmæssigt rigt mønster:Forskere bruger lyd til at forme fremtidens udskrivningUtrasound og computeralgoritmer styrer, hvordan materiale sætter sig i form. Kredit:University of Bath Forskere i Storbritannien har udviklet en måde at lokke mikroskopiske partikler og dråber til -
 Nye materialer:Strålende hvid uden pigmenterEn nanostruktureret polymerfilm modelleret efter den hvide bille Cyphochilus insulanus producerer en strålende hvid belægning. Kredit:Julia Syurik, KIT Polymerfolier, der er ekstremt tynde og kend
Nye materialer:Strålende hvid uden pigmenterEn nanostruktureret polymerfilm modelleret efter den hvide bille Cyphochilus insulanus producerer en strålende hvid belægning. Kredit:Julia Syurik, KIT Polymerfolier, der er ekstremt tynde og kend -
 En ny måde at udnytte spildt metan påMIT kemiprofessor Yogesh Surendranath og tre kolleger har fundet en måde at bruge elektricitet på, som potentielt kan komme fra vedvarende kilder, at omdanne metan til derivater af methanol. Forskerne
En ny måde at udnytte spildt metan påMIT kemiprofessor Yogesh Surendranath og tre kolleger har fundet en måde at bruge elektricitet på, som potentielt kan komme fra vedvarende kilder, at omdanne metan til derivater af methanol. Forskerne
- Offentlige ressourcer øger opdagelsen af lægemidler og giver indsigt i proteinfunktionen
- Lovgivere vil høre fra piloter, der har kritiseret Boeing
- Hemmeligheder om tidlige menneskelige forfædre kunne låses op af afrikanske regnskove
- Løbende honning, lodnet spinat og skinnende æbler:Overraskende fakta om din mad
- Team opnår den bedste måling af neutronstjernestørrelsen til dato
- Naturgaspriser, ikke krig mod kul, var nøglen til nedgang i kulkraft:undersøgelse


