Hvad var opdagelsen ved atomet?
Tidlige ideer (Ancient Grækenland - 1800s):
* Gamle grækere (Democritus, Leucippus): Filosofisk begreb om en udelelig partikel kaldet "atomoer" (hvilket betyder ukuttabelt).
* John Dalton (1803): Foreslog atomets første videnskabelige teori, baseret på eksperimentelle observationer. Han foreslog:
* Alt stof er lavet af atomer.
* Atomer af et givet element er identiske.
* Atomer kan ikke oprettes eller ødelægges.
* Atomer kombineres i hele talforhold for at danne forbindelser.
Den subatomiske verden:
* J.J. Thomson (1897): Opdagede elektronet, en negativt ladet partikel ved hjælp af katodestråle -rør. Dette udfordrede Daltons idé om, at atomet var udelelig.
* Ernest Rutherford (1911): Udførte det berømte guldfolieeksperiment, som viste, at atomet har en lille, tæt, positivt ladet kerne, med elektroner, der kredsede omkring det. Denne model er kendt som "Planetary Model".
* Niels Bohr (1913): Foreslog, at elektroner optager specifikke energiniveauer eller kredsløb omkring kernen og forklarer linjespektre for elementer.
* James Chadwick (1932): Opdagede neutronen, en neutral partikel, der findes i kernen, og afsluttede de grundlæggende partikler af atomet på det tidspunkt.
Moderne atomteori:
* kvantemekanik (1920'erne - nuværende): Udviklingen af kvantemekanik gav en mere sofistikeret forståelse af atomet. Elektroner tænkes ikke længere på som kredsende som planeter, men snarere som eksisterende i sandsynlighedskyer, beskrevet af bølgefunktioner.
* Partikelfysik: Med opdagelsen af kvarker og andre subatomære partikler ved vi nu, at selv protoner og neutroner ikke er grundlæggende, men består af mindre partikler.
Nøglepunkter:
* Atomet er ikke udelelig: Det består af mindre partikler.
* atomstruktur er kompleks: Elektroner kredserer ikke blot kernen, men findes i sandsynlighedsskyer.
* atomteori fortsætter med at udvikle sig: Nye opdagelser og modeller forfine konstant vores forståelse af atomet.
Opdagelsen af atomet er en løbende proces, der har revolutioneret vores forståelse af stof og universet.
 Varme artikler
Varme artikler
-
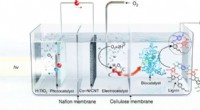 Nyt biokatalytisk system gør affaldsbiomasse til værdiskabende kemikalierSkematisk illustration af den tre-rums foto-elektro-biokemiske reaktor. Kredit:UNIST Et forskerhold, i fællesskab ledet af professor Ji Wook Jang, Professor Yong Hwan Kim, og professor Sang Hoon J
Nyt biokatalytisk system gør affaldsbiomasse til værdiskabende kemikalierSkematisk illustration af den tre-rums foto-elektro-biokemiske reaktor. Kredit:UNIST Et forskerhold, i fællesskab ledet af professor Ji Wook Jang, Professor Yong Hwan Kim, og professor Sang Hoon J -
 Teknik giver detaljeret overblik over, hvordan visse polymerer dannes, låse op for svar om kernedan…Forskningen pryder forsiden af Physical Chemistry Chemical Physics. Kredit:Royal Society of Chemistry Forestil dig en lille dråbe. Den indeholder vand, det brusende antiseptiske hydrogenperoxid,
Teknik giver detaljeret overblik over, hvordan visse polymerer dannes, låse op for svar om kernedan…Forskningen pryder forsiden af Physical Chemistry Chemical Physics. Kredit:Royal Society of Chemistry Forestil dig en lille dråbe. Den indeholder vand, det brusende antiseptiske hydrogenperoxid, -
 Kæmpe elektronisk ledningsevneændring drevet af kunstig omskiftning af krystaldimensionalitetDen direkte 3D-2D strukturelle faseovergang blev induceret i (Pb1?xSnx)Se-legeringsepitaksiale film ved anvendelse af en ikke-ligevægtsvækstteknik. Reversibel gigantisk elektronisk egenskabsændring bl
Kæmpe elektronisk ledningsevneændring drevet af kunstig omskiftning af krystaldimensionalitetDen direkte 3D-2D strukturelle faseovergang blev induceret i (Pb1?xSnx)Se-legeringsepitaksiale film ved anvendelse af en ikke-ligevægtsvækstteknik. Reversibel gigantisk elektronisk egenskabsændring bl -
 Biodiesel lavet af kasserede papkasserKonceptuelt diagram til fremstilling af biobrændstoffer ved hjælp af mikroorganismer som råmateriale til træbaseret biomasse. Kredit:Korea Institute of Science and Technology (KIST) Biludstødning
Biodiesel lavet af kasserede papkasserKonceptuelt diagram til fremstilling af biobrændstoffer ved hjælp af mikroorganismer som råmateriale til træbaseret biomasse. Kredit:Korea Institute of Science and Technology (KIST) Biludstødning
- Er hydrogen en heterogen eller homogen blanding?
- Tilslutter du brun elektrisk ledning til rød og blå sort ledning?
- Hvor mange gram H20 kan produceres ved reaktionen 2,40 mol C2 H2 med 7,40 mol O2?
- Hvad vil der ske, når solen bruger alt sit brint?
- Hvad inden i en stjerne tyngdekraften er afbalanceret af?
- Hvad er oxidationsantallet af kobber i iodid?


