Hvad er de fire faktorer, der påvirker hastigheden for en kemisk reaktion?
1. Koncentration af reaktanter: Højere koncentrationer af reaktanter fører til hyppigere kollisioner mellem molekyler, hvilket øger chancerne for vellykkede reaktioner.
2. Temperatur: Stigende temperatur giver molekyler mere kinetisk energi, hvilket resulterer i hyppigere og energiske kollisioner. Dette fører til en højere grad af vellykkede kollisioner og derfor en hurtigere reaktion.
3. overfladeareal: For reaktioner, der involverer faste stoffer, muliggør et større overfladeareal mere kontakt mellem reaktanter, hvilket øger reaktionshastigheden. Tænk på en sukkerterning, der opløses i vand sammenlignet med pulveriseret sukker.
4. tilstedeværelse af en katalysator: Katalysatorer fremskynder reaktioner uden at blive fortæret sig selv. De giver en alternativ reaktionsvej med lavere aktiveringsenergi, hvilket gør det lettere for reaktioner at forekomme.
Det er vigtigt at bemærke, at disse faktorer ofte arbejder sammen på komplekse måder. For eksempel kan en katalysator også påvirke den optimale temperatur for en reaktion.
Sidste artikelHvad er den sammensatte CUC12?
Næste artikelBeregn pH -værdien på 0,10 M HCI -opløsning?
 Varme artikler
Varme artikler
-
 En mere kortfattet måde at syntetisere tetrodotoxin påKredit:Unsplash/CC0 Public Domain Et lille internationalt team af forskere har udviklet en måde at syntetisere tetrodotoxin (TTX) ved at bruge langt færre trin end tidligere metoder. I deres papir
En mere kortfattet måde at syntetisere tetrodotoxin påKredit:Unsplash/CC0 Public Domain Et lille internationalt team af forskere har udviklet en måde at syntetisere tetrodotoxin (TTX) ved at bruge langt færre trin end tidligere metoder. I deres papir -
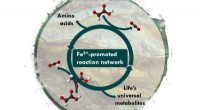 Lifes biokemiske netværk kunne have dannet sig spontant på JordenSyntese og nedbrydning af universelle metaboliske forstadier fremmet af jern Kredit:University of Strasbourg Forskere i Strasbourg, Frankrig, har fundet ud af at blande to små biomolekyler, glyoxy
Lifes biokemiske netværk kunne have dannet sig spontant på JordenSyntese og nedbrydning af universelle metaboliske forstadier fremmet af jern Kredit:University of Strasbourg Forskere i Strasbourg, Frankrig, har fundet ud af at blande to små biomolekyler, glyoxy -
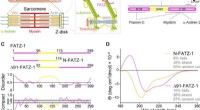 Bestil fra uorden i sarkomerenProteiner fra FATZ-familien viser iboende lidelse. (A) Skema af den tværstribede muskelsarkomer og nærbillede af F-actin/α-actinin/FATZ interaktioner i Z-disk. (B) Skema af FATZ-1-interaktomet og bind
Bestil fra uorden i sarkomerenProteiner fra FATZ-familien viser iboende lidelse. (A) Skema af den tværstribede muskelsarkomer og nærbillede af F-actin/α-actinin/FATZ interaktioner i Z-disk. (B) Skema af FATZ-1-interaktomet og bind -
 CO2 som råstof til plast og andre produkterLysmikrofotografi af celler af den gramnegative bakterie-Methylorubrum extor-quens AM1. Kredit:Fraunhofer-Gesellschaft Kuldioxid er en af de vigtigste drivkræfter bag klimaændringer - hvilket be
CO2 som råstof til plast og andre produkterLysmikrofotografi af celler af den gramnegative bakterie-Methylorubrum extor-quens AM1. Kredit:Fraunhofer-Gesellschaft Kuldioxid er en af de vigtigste drivkræfter bag klimaændringer - hvilket be
- Hvad er de 5 grene af fysik og deres betydning?
- En placering på jorden, hvor hver type pladegrænse er til stede?
- Hvilken har højere elektronaffinitetsjod eller brom?
- Redstone familieblokke flytter for at udvande sin CBS stemmemagt
- Hvordan dannes laterit jord?
- Får og bruger celler energi gennem faciliteret diffusion?


