Hvorfor er det Francium mest aktive metal?
* Elektropositivitet: Francium sidder i bunden af gruppe 1 (alkalimetaller) på den periodiske tabel. Elementer i denne gruppe er kendt som alkalimetaller, og de er alle meget reaktive. Når du bevæger dig ned ad gruppen, øges reaktiviteten. Dette skyldes, at den yderste elektron (valenselektron) kommer længere fra kernen, hvilket gør det lettere at fjerne og danne en positiv ion (kation). Francium har den største atomradius for alle alkalimetaller, hvilket betyder, at dens valenselektron er længst væk fra kernen og oplever den mindste tiltrækning.
* lav ioniseringsenergi: Francium har den laveste ioniseringsenergi for alle elementer. Ioniseringsenergi er den energi, der kræves for at fjerne et elektron fra et atom. Fordi Franciums Valence Electron holdes svagt, kræver det meget lidt energi at fjerne det. Dette gør Francium meget sandsynligt at miste en elektron og danne en positiv ion.
* Høj elektronegativitet: Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner. Francium har en meget lav elektronegativitet, hvilket betyder, at den har en stærk tendens til at miste sin elektron i stedet for at få en.
Kortfattet: Kombinationen af Franciums store atomradius, lav ioniseringsenergi og lav elektronegativitet gør det til det mest reaktive metal. Dens tendens til at miste sin elektron fører let til sin meget reaktive karakter. Imidlertid er Francium et meget sjældent og radioaktivt element, hvilket gør det vanskeligt at studere dets reaktivitet i detaljer.
 Varme artikler
Varme artikler
-
 Uregerbart kræftprotein bliver narkotika, takket være buskCurcusone D, den første syntetiserede BRAT-1-hæmmer, stammer oprindeligt fra roden af Jatropha curcas, en busk hjemmehørende i Amerika. Kredit:Forest og Kim Starr En kemiker fra Purdue Universit
Uregerbart kræftprotein bliver narkotika, takket være buskCurcusone D, den første syntetiserede BRAT-1-hæmmer, stammer oprindeligt fra roden af Jatropha curcas, en busk hjemmehørende i Amerika. Kredit:Forest og Kim Starr En kemiker fra Purdue Universit -
 Ostefremstilling kan være nøglen til sundere babyer og bekæmpelse af sygdomKredit:University of Melbourne Forskere fra University of Melbourne har udviklet en proces til at høste nøgleingredienser fra valle, som kan bruges som forløbere, ikke kun til at give billig ernæri
Ostefremstilling kan være nøglen til sundere babyer og bekæmpelse af sygdomKredit:University of Melbourne Forskere fra University of Melbourne har udviklet en proces til at høste nøgleingredienser fra valle, som kan bruges som forløbere, ikke kun til at give billig ernæri -
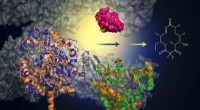 Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibioti…Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønner
Forskere udvikler grønnere og mere effektiv metode til fremstilling af næste generations antibioti…Med tilføjelsen af en murin-afledt biokatalysator (grøn), kan dette konstruerede protein tilføje et fluoridatom for at skabe makrolidanaloger (struktur, til højre). Denne tilgang tilbyder en grønner -
 Mikroovn nye materialerHvis du ser omhyggeligt i midten af dette billede, du vil se den $30 mikrobølgeovn, som Reeja Jayan omkonstruerede til at starte sine tidlige eksperimenter. Kredit:Reeja Jayan Mikrobølgeovne er
Mikroovn nye materialerHvis du ser omhyggeligt i midten af dette billede, du vil se den $30 mikrobølgeovn, som Reeja Jayan omkonstruerede til at starte sine tidlige eksperimenter. Kredit:Reeja Jayan Mikrobølgeovne er
- Sporing af proteinpatruljere
- Hvilket molekyle betragtes som det universelle monosaccharid?
- Er det voksagtige lag af et blad tykkere end epidermis?
- Hvilke vulkaner er voldelige med stejle skråninger?
- Ny teknik til polymerfremstilling med reducerede opløsningsmidler rettet mod køretøj, emballagepr…
- Politibetjente åbner op om kropsbårne kameraer i en post-Ferguson-æra


