Kan chlorid i kaliumgas slukket og fordampe som klor?
Her er hvorfor:
* Kemisk binding: Kaliumchlorid (KCL) er en ionisk forbindelse. Dette betyder, at det findes som et krystalgitter med stærke elektrostatiske attraktioner mellem positivt ladede kaliumioner (K+) og negativt ladede chloridioner (Cl-). Klorgas (CL2) er på den anden side et kovalent molekyle med et delt elektronpar mellem to kloratomer.
* Fordampning vs. sublimering: Klorgas kan fordampe fra en flydende tilstand og overføres direkte til en gasfase. Kaliumchlorid er imidlertid et fast stof ved stuetemperatur. For at det bliver en gas, er det nødvendigt at gennemgå sublimering - en direkte overgang fra fast til gas.
* Høj sublimeringstemperatur: Kaliumchlorid har en meget høj sublimeringstemperatur (ca. 1415 ° C eller 2581 ° F). Dette betyder, at det kræver en masse energi for at bryde de stærke ioniske bindinger og overgangen til en gasformig tilstand.
* Nedbrydning: Hvis du skulle opvarme kaliumchlorid til ekstremt høje temperaturer, ville det sandsynligvis nedbrydes, før det sublimeres. Dette betyder, at forbindelsen ville nedbrydes i dens bestanddele, kalium (K) og chlor (CL), snarere end at danne kaliumchloridgas.
Kortfattet: Mens klorgas kan fordampe, fordamper kaliumchlorid ikke som klor. Det har en meget høj sublimeringstemperatur og vil sandsynligvis nedbrydes, før den kunne skifte til en gasformig tilstand.
Sidste artikelEr natriumhydroxid opløst i vand en kemisk eller fysisk ændring?
Næste artikelHvilket element er CH2BR2?
 Varme artikler
Varme artikler
-
 Forskere udvikler antimikrobiel, plantebaseret madpakke designet til at erstatte plastikKredit:Pixabay/CC0 Public Domain Med sigte på at producere miljøvenlige alternativer til plastemballage og -beholdere har en Rutgers-forsker udviklet en biologisk nedbrydelig, plantebaseret belægni
Forskere udvikler antimikrobiel, plantebaseret madpakke designet til at erstatte plastikKredit:Pixabay/CC0 Public Domain Med sigte på at producere miljøvenlige alternativer til plastemballage og -beholdere har en Rutgers-forsker udviklet en biologisk nedbrydelig, plantebaseret belægni -
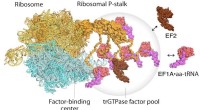 Højhastigheds atomkraftmikroskopi visualiserer celleproteinfabrikkerModel til oversættelse af ribosomer og forlængelsesfaktorer. EF1A • GTP • aatRNA og EF2 samles til den ribosomale stilk på det translaterende ribosom. Oversættelsesfaktorpuljen bidrager til effektiv p
Højhastigheds atomkraftmikroskopi visualiserer celleproteinfabrikkerModel til oversættelse af ribosomer og forlængelsesfaktorer. EF1A • GTP • aatRNA og EF2 samles til den ribosomale stilk på det translaterende ribosom. Oversættelsesfaktorpuljen bidrager til effektiv p -
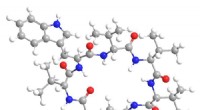 Naturlige antibiotika multi-level angrebsstrategi forhindrer modstandLugdunin er et cyklisk peptid med 21 medlemmer, der består af 6 aminosyrerester plus en thiazolidindel. Fem af aminosyrerne er L-valin, og den sjette er L-tryptophan. Kredit:American Chemical Society
Naturlige antibiotika multi-level angrebsstrategi forhindrer modstandLugdunin er et cyklisk peptid med 21 medlemmer, der består af 6 aminosyrerester plus en thiazolidindel. Fem af aminosyrerne er L-valin, og den sjette er L-tryptophan. Kredit:American Chemical Society -
 Mekanismer for bevaring af blødt væv og protein i Tyrannosaurus rexEt fossilt eksemplar af T. rex (AMNH 5027) udstillet på American Museum of Natural History, i 2019. Kredit:Nationalmuseet for Naturhistorisk, New York City. amnh.org/exhibitions/permanent/saurischian-
Mekanismer for bevaring af blødt væv og protein i Tyrannosaurus rexEt fossilt eksemplar af T. rex (AMNH 5027) udstillet på American Museum of Natural History, i 2019. Kredit:Nationalmuseet for Naturhistorisk, New York City. amnh.org/exhibitions/permanent/saurischian-
- Har CaCl2 en højde af ledningsværdien, når den blev opløst i destilleret vand?
- Hvilket værktøj vil hjælpe dig med at måle, hvordan forskellige farver absorberer energien i sol…
- En bold skydes ud af en kanon med indledende hastighed 30ms ved 30 grader over vandret. Hvor længe …
- Hvordan virker partikler i en bølge?
- Hvad er ligningen mellem ammoniumsulfat og kaliumhydroxid?
- Hvilke typer membraner, der findes i den menneskelige krop, indeholder ikke epitelvæv?


